
【题目】下列有关金属钠的说法中,不正确的是
A.钠应保存在煤油中
B.钠在氧气中燃烧生成淡黄色的Na2O2
C.钠可以从硫酸铜溶液中还原出铜单质
D.钠元素在自然界中都是以化合态存在
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】已知:25℃时H2C2O4的pKa1=1.22,pK a2=4.19,CH3COOH的pK a=4.76(电离常数K的负对数-1gK=pK)。下列说法正确的是
A. 浓度均为0.1mol·L-1NH4HC2O4和CH3COONH4溶液中:c(NH4+)前者小于后者
B. 0.1 mol·L-1KHC2 O 4溶液滴加氨水至中性:(NH4+)<c(C2O42-)
C. 0.1 mol·L-1K2C2O4溶液滴加盐酸至pH=1.22:C(H+)-c(OH-)=c(Cl-)-3c(HC2O4-)
D. 0.1 mol·L-1CH3COONa溶液中滴加KHC2O4溶液至PH=4.76;c(K+)>c(Na+)>c(HC2O4-)>c(C2O42-)>c(CH3COO-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,利用如图所示装置可实现有机物的储氢,下列有关说法正确的是( )
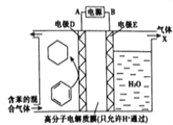
A. 气体X是氢气,电极E是阴极
B. H+由左室进入右室,发生还原反应
C. 该储氢过程就是C6H6与氢气反应过程
D. 电极D的电极反应式为C6H6+6H++6e-=C6H12
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】第VA族元素单质及其化合物在生产、生活中有重要的用途。
(1)下列说法正确的是__________(填序号)。
a.含氧酸的酸性:HNO3>H3PO4>H3AsO4 b.原子半径:S >P>As
c.氢化物的稳定性NH3>PH3> AsH3d.AsH3电子式是![]()
(2)雌黄(As2S3 )和雄黄(As4S4)都是自然界中常见的砷化物,早期都曾用作绘画颜料,因都有抗病毒疗效也用来入药。砷元素有+2、+3两种常见价态。一定条件下,雌黄和雄黄的转化关系如图所示。
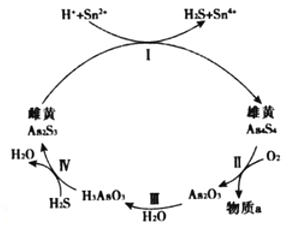
①Ⅱ中若1molAs4S4反应转移28mole-,a物质是__________。
②Ⅰ中反应的离子方程式是____________________________________。
(3)亚砷酸(H3AsO3)可以用于治疗白血病,其在溶液中存在多种微粒形态,各种微粒物质的量分数与溶液的pH关系如图所示。

①人体血液的pH在7.35~7.45 之间,用药后人体中含砷元素的主要微粒是___________。
②H3AsO3的一级电离常数是6×10-10mol·L-1,n(H3AsO3)∶n(H2AsO3-)=1∶1时,溶液的pH=___________(列出计算式即可)。
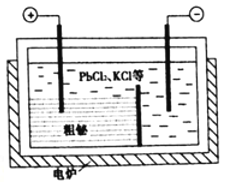
(4)由辉铋矿(主要成分为Bi2S3,含杂质PbO2等)制备Bi2O3的工艺如图所示:

①“浸出”时Bi2S3与FeCl3 溶液反应的离子方程式为________________________________。
②“置换”时生成单质铋的离子方程式为____________________________________。
③“粗秘”中含有的杂质主要是Pb,通过熔融盐电解精炼可达到除杂的目的,其装置示意图如所示。电解后阳极底部留下的为精铋。写出阳极电极反应的方程式__________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁在人体中含量只有0.004%,微乎其微,但铁是组成血红蛋白的一个不可缺少的成员。正二价铁离子易被吸收,给贫血者补充铁时,应给予含Fe2+的亚铁盐,如硫酸亚铁。服用维生素C,可使食物中的Fe3+转化成Fe2+,有利于人体吸收。
(1)在人体中进行Fe2+![]() Fe3+的转化时,②中的Fe3+作_______剂。
Fe3+的转化时,②中的Fe3+作_______剂。
(2)“服用维生素C,可使食物中的Fe3+转化成Fe2+”这句话指出,维生素C在这一反应中做_____剂,具有_______性。
(3)市场出售的某种麦片中含有微量的颗粒细小的还原铁粉,这些铁粉在人体胃酸(主要成分是盐酸)的作用下转化成亚铁盐。此反应的离子方程式为_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于分散系的叙述不正确的是
A. 分散系的分类:![]()
B. 用平行光照射FeCl3溶液和Fe(OH)3胶体,可以加以区分
C. 把FeCl3饱和溶液滴入到蒸馏水中,以制取Fe(OH)3胶体
D. 如图所示是树林中的晨曙,该反应与丁达尔效应有关
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关溶液中微粒的物质的量浓度关系正确的是( )
A. 某弱酸的酸式盐NaHA溶液中一定有:c(OH﹣)+2c(A2﹣)=c(H+)+c(H2A)
B. 0.2 molL﹣1 CH3COONa溶液与0.1 molL﹣1盐酸等体积混合后的酸性溶液中:c(CH3COO﹣)>c(CH3COOH)>c(Cl﹣)>c(H+)
C. 室温下,向100ml0.5mol/L的Na2CO3溶液中加入0.05molCaO,  溶液中增大
溶液中增大
D. 0.1 molL﹣1(NH4)2Fe(SO4)2溶液中:c(NH4+)+c(NH3H2O)+c(Fe2+)=0.3 molL﹣1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】W、X、Y、Z是四种原子序数依次增大的短周期元素。a、b、c、d、e是由这些元素组成的化合物,气体a的水溶液呈碱性,c为红棕色气体,e是由W、Y、Z元素形成的化合物,m为元素Y形成的单质。上述物质的转化关系如图所示,下列说法正确的是
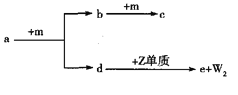
A. 简单离子半径:Z>Y B. 简单气态氢化物的稳定性:X>Y
C. e为离子化合物,含有离子键和共价键 D. W、X、Y形成的化合物不可能是离子化合物
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com