
【题目】第VA族元素单质及其化合物在生产、生活中有重要的用途。
(1)下列说法正确的是__________(填序号)。
a.含氧酸的酸性:HNO3>H3PO4>H3AsO4 b.原子半径:S >P>As
c.氢化物的稳定性NH3>PH3> AsH3d.AsH3电子式是![]()
(2)雌黄(As2S3 )和雄黄(As4S4)都是自然界中常见的砷化物,早期都曾用作绘画颜料,因都有抗病毒疗效也用来入药。砷元素有+2、+3两种常见价态。一定条件下,雌黄和雄黄的转化关系如图所示。
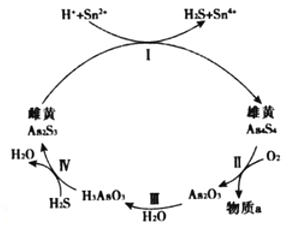
①Ⅱ中若1molAs4S4反应转移28mole-,a物质是__________。
②Ⅰ中反应的离子方程式是____________________________________。
(3)亚砷酸(H3AsO3)可以用于治疗白血病,其在溶液中存在多种微粒形态,各种微粒物质的量分数与溶液的pH关系如图所示。

①人体血液的pH在7.35~7.45 之间,用药后人体中含砷元素的主要微粒是___________。
②H3AsO3的一级电离常数是6×10-10mol·L-1,n(H3AsO3)∶n(H2AsO3-)=1∶1时,溶液的pH=___________(列出计算式即可)。
(4)由辉铋矿(主要成分为Bi2S3,含杂质PbO2等)制备Bi2O3的工艺如图所示:

①“浸出”时Bi2S3与FeCl3 溶液反应的离子方程式为________________________________。
②“置换”时生成单质铋的离子方程式为____________________________________。
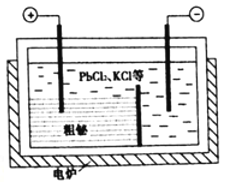
③“粗秘”中含有的杂质主要是Pb,通过熔融盐电解精炼可达到除杂的目的,其装置示意图如所示。电解后阳极底部留下的为精铋。写出阳极电极反应的方程式__________________________。
【答案】 ac SO2 2As2S3+4H++2Sn2+=2H2S+2Sn4++As4S4 H3AsO3 10-lg6 Bi2S3+6Fe3+=6Fe2++3S+2Bi3+ 2Bi3++3Fe=3Fe2++2Bi Pb-2e-=Pb2+
【解析】(1)a项,同主族元素,原子序数越大非金属性越弱,最高价氧化物对应水化物的酸性越弱,所以酸性:HNO3>H3PO4>H3AsO4,故a正确;b项,同周期元素原子序数越大半径越小,同主族元素原子序数越大半径越大,所以原子半径:S<P<As,故b错误;c项,同主族元素,原子序数越大非金属性越弱,氢化物的稳定性越小,所以稳定性:NH3>PH3>AsH3,故c正确;d项,AsH3电子式是![]() ,故d错误。
,故d错误。
(2)①如图所示,As4S4与O2反应,生成As2O3和物质a,1molAs4S4反应转移28mole-,根据得失电子守恒,1mol-3价的S失去7mole-,则生成+4价S的氧化物,故物质a为SO2。②反应Ⅰ为As2S3在酸性条件下与Sn2+反应生成As4S4、H2S和Sn4+,根据原子守恒和电荷守恒,离子方程式为:2As2S3+4H++2Sn2+=2H2S+2Sn4++As4S4。
(3)①由图像可得,pH在7.35~7.45之间时,含砷元素的主要微粒是H3AsO3。②H3AsO3的一级电离常数是6×10-10mol·L-1,则Ka1=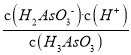 =6×10-10mol·L-1,又因为n(H3AsO3)∶n(H2AsO3-)=1∶1,则c(H3AsO3)=c(H2AsO3-),所以c(H+)=6×10-10mol·L-1,因此pH=-lgc(H+)=-lg(6×10-10)=10-lg6。
=6×10-10mol·L-1,又因为n(H3AsO3)∶n(H2AsO3-)=1∶1,则c(H3AsO3)=c(H2AsO3-),所以c(H+)=6×10-10mol·L-1,因此pH=-lgc(H+)=-lg(6×10-10)=10-lg6。
(4)①分析流程可得,辉铋矿加入FeCl3溶液和盐酸,FeCl3将-2价S氧化为S单质,同时生成FeCl2和BiCl2,盐酸可防止FeCl2和BiCl2水解生成不溶性沉淀,故“浸出”时Bi2S3与FeCl3溶液反应的离子方程式为:Bi2S3+6Fe3+=6Fe2++3S+2Bi3+。②浸出液主要含Fe2+和Bi3+,加入铁粉发生置换反应生成粗铋,离子方程式为:2Bi3++3Fe=3Fe2++2Bi。③“粗秘”中含有的杂质主要是Pb,通过熔融盐电解精炼可达到除杂的目的,电解后阳极底部留下的为精铋,则电解精炼时粗铋作阳极,Pb发生氧化反应生成Pb2+进入溶液,故阳极电极反应式为:Pb-2e-=Pb2+。


 小学学习好帮手系列答案
小学学习好帮手系列答案 小学同步三练核心密卷系列答案
小学同步三练核心密卷系列答案科目:高中化学 来源: 题型:
【题目】下列指定反应的离子方程式正确的是
A. NO2通入水中:3NO2+H2O=2H++2NO2-+NO
B. Fe(OH)3溶于HI溶液:Fe(OH)3+3H+=Fe3++3H2O
C. (NH4)2SO4溶液中加入Ba(OH)2溶液:NH4++SO42-+Ba2++OH-=BaSO4↓+NH3·H2O
D. 向NaAlO2溶液中滴入NaHCO3溶液产生白色沉淀:AlO2-+HCO3-+H2O=Al(OH)3↓+CO![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.尿素[CO(NH2)2]是一种非常重要的高效氮肥,工业上以NH3、CO2为原料生产尿素,该反应实际为两步反应:
第一步:2NH3(g)+CO2(g)===H2NCOONH4(s) ΔH=-272kJ·mol-1
第二步:H2NCOONH4(s)===CO(NH2)2(s)+H2O(g) ΔH=+138kJ·mol-1
(1)写出工业上以NH3、CO2为原料合成尿素的热化学方程式:_________________________
(2)某实验小组模拟工业上合成尿素的条件,在一体积为0.5 L密闭容器中投入4 mol氨和1mol二氧化碳,实验测得反应中各组分的物质的量随时间的变化如下图所示:
已知总反应的快慢由慢的一步决定,则合成尿素总反应的快慢由第_________步反应决定,总反应进行到_________min时到达平衡。
(3)电解尿素[CO(NH2)2]的碱性溶液制纯净氢气的过程中同时产生氮气。电解时,阳极的电极反应式为________________________________。
Ⅱ.用焦炭还原NO2的反应为:2NO2(g)+2C(s )![]() N2(g)+2CO2(g),在恒温条件下,1 mol NO2和足量C发生该反应,测得平衡时NO2和CO2的物质的量浓度与平衡总压的关系如图所示:
N2(g)+2CO2(g),在恒温条件下,1 mol NO2和足量C发生该反应,测得平衡时NO2和CO2的物质的量浓度与平衡总压的关系如图所示:
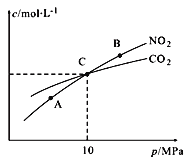
①A、B两点的浓度平衡常数关系:Kc(A)_______Kc(B) (填 “﹥”、“<”或“﹦”)。
②计算C点时该反应的压强平衡常数Kp(C)=______(Kp是用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在无色透明溶液中,下列各组中的离子一定能大量共存的是( )
A.K+、H+、SO42-、MnO4-B.Na+、Ca2+、Cl-、NO3-
C.Ag+、H+、Cl-、CH3COO-D.Ba2+、K+、OH-、SO42-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某澄清混合溶液中所含离子的浓度如下表所示,则M可能为( )
离子 | NO3- | SO42- | H+ | M |
浓度/(mol/L) | 2 | 1 | 2 | 2 |
A.Cl-B.Ba2+C.Na+D.Mg2+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Fe2O3+2Al![]() Al2O3+2Fe所属基本反应类型是______。在该反应中______元素的化合价升高,该元素的原子______电子,被______。该反应中,Fe2O3发生了________反应,Al发生了______反应,______是氧化剂,__是还原剂,______是氧化产物,_____是还原产物。
Al2O3+2Fe所属基本反应类型是______。在该反应中______元素的化合价升高,该元素的原子______电子,被______。该反应中,Fe2O3发生了________反应,Al发生了______反应,______是氧化剂,__是还原剂,______是氧化产物,_____是还原产物。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关金属钠的说法中,不正确的是
A.钠应保存在煤油中
B.钠在氧气中燃烧生成淡黄色的Na2O2
C.钠可以从硫酸铜溶液中还原出铜单质
D.钠元素在自然界中都是以化合态存在
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】取碘水四份于试管中,编号为Ⅰ、Ⅱ、Ⅲ、Ⅳ,分别加入苯、CCl4、酒精、NaCl溶液,振荡后静置,现象正确的是( )
A.Ⅰ中溶液分层,下层呈紫红色B.Ⅱ中溶液分层,下层呈紫红色
C.Ⅲ中溶液分层,下层呈棕黄色D.Ⅳ中溶液分层
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用锌冶炼废渣(ZnSO4、CuSO4、FeSO4、FeS2、Al2O3、SiO2)制备ZnSO4和Fe2O3的实验流程如下:

已知:“碱浸”时,NaOH溶液浓度越大越粘稠,越容易生成铝硅酸钠沉淀。
(1) “水浸”阶段需在70~80℃条件下进行,适宜的加热方式为________________。
(2)“氧化”阶段是将Fe2+氧化后进一步生成Fe(OH)3,从反应产物的角度分析,以氯水替代H2O2的缺点是①使ZnSO4中混有ZnCl2;②________________。
(3)“灼烧”时FeS2发生反应的化学方程式为________________。使用的装置如右图,仪器a的名称为________________。
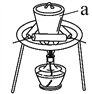
(4) “碱浸”阶段,在其它条件不变的情况下,所得固体中Fe2O3含量随NaOH溶液的浓度的增大而增大,但当氢氧化钠浓度大于12 mol·L-1时,Fe2O3含量反而降低,其原因是________________。
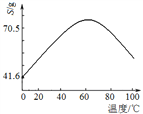
(5)“滤液Ⅰ”溶质主要是ZnSO4和CuSO4。已知硫酸锌晶体的溶解度随温度变化如右图,请设计从“滤液Ⅰ”中获取ZnSO4晶体的实验方案:________________(实验中须使用的试剂有:Zn粉、稀H2SO4、酒精)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com