
【题目】下列指定反应的离子方程式正确的是
A. NO2通入水中:3NO2+H2O=2H++2NO2-+NO
B. Fe(OH)3溶于HI溶液:Fe(OH)3+3H+=Fe3++3H2O
C. (NH4)2SO4溶液中加入Ba(OH)2溶液:NH4++SO42-+Ba2++OH-=BaSO4↓+NH3·H2O
D. 向NaAlO2溶液中滴入NaHCO3溶液产生白色沉淀:AlO2-+HCO3-+H2O=Al(OH)3↓+CO![]()
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】下列叙述中,正确的是( )
A.标准状况下,Cl2的摩尔质量为71g
B.Na2CO3属于钠盐、又属于碳酸盐,这是用交叉分类法分类的
C.摩尔是用来衡量微观粒子多少的一种物理量
D.氧化还原反应一定有氧元素参加
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列化学反应中,属于氧化还原反应的是
A. SO3+H2O=H2SO4 B. CaCO3![]() CaO+CO2↑
CaO+CO2↑
C. Zn+H2SO4=ZnSO4+H2↑ D. AgNO3+HCl=AgCl↓+HNO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、W是短周期元素,原子序数依次递增。X与Z位于同一主族,Y元素的单质既能与盐酸反应也能与NaOH溶液反应,Z原子的最外层电子数是次外层电子数的一 半,Y、Z、W原子的最外层电子数之和为14。
(1)XW4的空间构型为____,HWO的结构式为____,Z在元素周期表中的位置是____。
(2)①X、Y、Z、W原子半径由大到小依次是____(填元素符号)。
②X、Z、W最高价氧化物水化物酸性由强到弱依次是_________。(填化学式)。
(3)W同族上一周期元素单质不能把W元素从其钠盐的水溶液中置换出来,用化学方程式解释____________________。
(4)①家用“管道通”的有效成分是烧碱和Y的单质,使用时需加入一定量的水,此时发生反应的化学方程式为________________。
②含Y元素的盐与小苏打溶液可用作泡沫灭火剂,写出灭火时发生反应的离子方程式_________。
(5)NW3是黄色油状液体,无漂白性,在热水中会发生水解。NW3的电子式为____。若取该液体滴入50℃左右的热水中,片刻后取该热水溶液滴到干燥的红色石蕊试纸上,试纸先变蓝后褪色。写出NW3在热水中发生水解的化学方程式________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定的条件下,将 2mol SO2和1mol O2充入一定容密闭容器中,发生下列反应:2SO2(g)+O2(g) ![]() 2SO3(g)△H=-197 kJ/mol,当达到平衡状态时,下列说法中正确的是( )
2SO3(g)△H=-197 kJ/mol,当达到平衡状态时,下列说法中正确的是( )
A. SO2 和 SO3 共有 2 mol B. 放出热量197 kJ
C. 生成 2 mol SO3 D. 含有氧原子共有3mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】导电性实验可以作为研究电解质电离本质及反应机理的有效方法。
(1)在如下图所示的装置里,若灯泡亮,广口瓶内的物质A可以是________(填序号)。
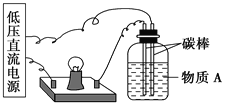
①干燥的氯化钠晶体 ②干燥的氢氧化钠晶体 ③蔗糖晶体 ④酒精 ⑤氯化钠溶液 ⑥氢氧化钠溶液 ⑦稀盐酸 ⑧硫酸铜溶液
(2)在电解质溶液的导电性装置(如图所示)中,若向某一电解质溶液中逐滴加入另一溶液时,则灯泡由亮变暗,至熄灭后又逐渐变亮的是________。
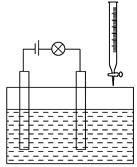
A.盐酸中逐滴加入食盐溶液
B.硫酸中逐滴加入氢氧化钠溶液
C.石灰乳中滴加稀盐酸
D.硫酸中逐滴加入氢氧化钡溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:25℃时H2C2O4的pKa1=1.22,pK a2=4.19,CH3COOH的pK a=4.76(电离常数K的负对数-1gK=pK)。下列说法正确的是
A. 浓度均为0.1mol·L-1NH4HC2O4和CH3COONH4溶液中:c(NH4+)前者小于后者
B. 0.1 mol·L-1KHC2 O 4溶液滴加氨水至中性:(NH4+)<c(C2O42-)
C. 0.1 mol·L-1K2C2O4溶液滴加盐酸至pH=1.22:C(H+)-c(OH-)=c(Cl-)-3c(HC2O4-)
D. 0.1 mol·L-1CH3COONa溶液中滴加KHC2O4溶液至PH=4.76;c(K+)>c(Na+)>c(HC2O4-)>c(C2O42-)>c(CH3COO-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液中含有Ba2+、Cu2+、Ag+,现用NaOH溶液、盐酸和Na2SO4溶液将这三种离子逐一沉淀分离。其流程如下图,已知沉淀2为蓝色。
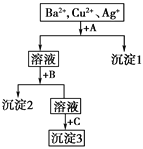
(1)写出沉淀的化学式:沉淀1______;沉淀3________。
(2)写出混合液+A的离子方程式_________________,溶液+B的离子方程式________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】第VA族元素单质及其化合物在生产、生活中有重要的用途。
(1)下列说法正确的是__________(填序号)。
a.含氧酸的酸性:HNO3>H3PO4>H3AsO4 b.原子半径:S >P>As
c.氢化物的稳定性NH3>PH3> AsH3d.AsH3电子式是![]()
(2)雌黄(As2S3 )和雄黄(As4S4)都是自然界中常见的砷化物,早期都曾用作绘画颜料,因都有抗病毒疗效也用来入药。砷元素有+2、+3两种常见价态。一定条件下,雌黄和雄黄的转化关系如图所示。
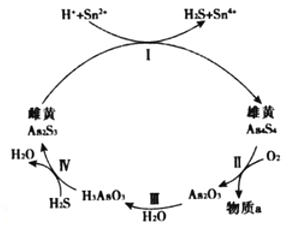
①Ⅱ中若1molAs4S4反应转移28mole-,a物质是__________。
②Ⅰ中反应的离子方程式是____________________________________。
(3)亚砷酸(H3AsO3)可以用于治疗白血病,其在溶液中存在多种微粒形态,各种微粒物质的量分数与溶液的pH关系如图所示。

①人体血液的pH在7.35~7.45 之间,用药后人体中含砷元素的主要微粒是___________。
②H3AsO3的一级电离常数是6×10-10mol·L-1,n(H3AsO3)∶n(H2AsO3-)=1∶1时,溶液的pH=___________(列出计算式即可)。
(4)由辉铋矿(主要成分为Bi2S3,含杂质PbO2等)制备Bi2O3的工艺如图所示:

①“浸出”时Bi2S3与FeCl3 溶液反应的离子方程式为________________________________。
②“置换”时生成单质铋的离子方程式为____________________________________。
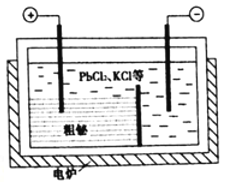
③“粗秘”中含有的杂质主要是Pb,通过熔融盐电解精炼可达到除杂的目的,其装置示意图如所示。电解后阳极底部留下的为精铋。写出阳极电极反应的方程式__________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com