
����Ŀ��������ʵ�������Ϊ�о�����ʵ��뱾�ʼ���Ӧ��������Ч������
(1)������ͼ��ʾ��װ����������������ƿ�ڵ�����A������________(�����)��
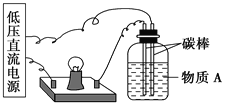
�ٸ�����Ȼ��ƾ��塡�ڸ�����������ƾ��塡�����Ǿ��塡�ܾƾ������Ȼ�����Һ��������������Һ����ϡ���ᡡ������ͭ��Һ
(2)�ڵ������Һ�ĵ�����װ��(��ͼ��ʾ)�У�����ijһ�������Һ����μ�����һ��Һʱ������������䰵����Ϩ�������������________��
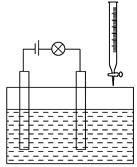
A����������μ���ʳ����Һ
B����������μ�������������Һ
C��ʯ�����еμ�ϡ����
D����������μ�������������Һ
���𰸡��ݢޢߢ�D
��������
��1���������Һ������������Ũ�ȳ����ȡ������ӵ�ɳ����ȣ�����������˵�����ƿ�е������Һ�к��д��������ƶ����ӣ����Ȼ�����Һ��������������Һ����ϡ���ᡢ ������ͭ��Һ�ж����д��������ƶ����ӣ������ܵ��磬ʣ�༸�������ж������������ƶ����ӣ����Բ��ܵ��磬��ѡ�ݢޢߢ���
��2��A��������Һ����μ���ʳ�Σ���Һ�е��Ũ�Ȳ���Ϊ0�����ݲ�����Ϩ�𣬹�A����B����������μ�������������Һ���������ƣ���Һ���Ũ�Ȳ�Ϊ0�����ݲ�����Ϩ�𣬹�B����C��ʯ�����м���ϡ���ᣬ��ȫ��Ӧʱ�����Ȼ��ƣ���Һ���Ũ�Ȳ�Ϊ0�����ݲ�����Ϩ�𣬹�C����D��������Һ����μ���������������ȫ��Ӧ�������ᱵ����Һ�м���û�����ӣ���Һ�е��Ũ��Ϊ0������Ϩ�𣬼����μ�����������Һ������������������Һ�б��������������������࣬��������������D��ȷ����ѡD��


 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��þ�����ֱ����Ũ�ȵ�����Ĺ���ϡ���ᷴӦ��������������(V)��ʱ��(t)�Ĺ�ϵ��ͼ��ʾ�������й��ڷ�Ӧ��þ������������ȷ����

A. �������ʵ���֮��Ϊ3��2
B. ��������֮��Ϊ3��2
C. ����Ħ������֮��Ϊ2��3
D. ��������H2SO4�����ʵ���֮��Ϊ2��3
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
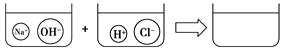
����Ŀ�����ֽⷴӦ�ܹ���������Ϊ����Щ��Ӧ���к���һЩ�����⡱�����������ӣ����������ϡ��練Ӧ��BaCl2+Na2SO4![]() BaSO4��+2NaCl���У�ʵ�ʲμӷ�Ӧ��������Ba2+��SO42������Cl��Na+���ǡ��Թ��ߡ�����û�вμӷ�Ӧ�����㷴Ӧ��K2CO3+2HCl��2KCl+CO2��+H2O����ʵ�ʲμӷ�Ӧ��������________���÷�Ӧ�����ӷ���ʽ��____________________________������������������ͼ�ұߵ������л�������NaOH��Һ��ϡ���ᷴӦ�����ʾ��ͼ��
BaSO4��+2NaCl���У�ʵ�ʲμӷ�Ӧ��������Ba2+��SO42������Cl��Na+���ǡ��Թ��ߡ�����û�вμӷ�Ӧ�����㷴Ӧ��K2CO3+2HCl��2KCl+CO2��+H2O����ʵ�ʲμӷ�Ӧ��������________���÷�Ӧ�����ӷ���ʽ��____________________________������������������ͼ�ұߵ������л�������NaOH��Һ��ϡ���ᷴӦ�����ʾ��ͼ��
 ________
________
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��һ�ִӺ�Br����ˮ����ȡBr2�Ĺ������������ˡ���������ʮ������ȡ������Ȳ��衣��֪��
Br2 | CCl4 | ��ʮ���� | |
�ܶ�/g��cm��3 | 3.119 | 1.595 | 0.753 |
�е�/�� | 58.76 | 76.8 | 215��217 |
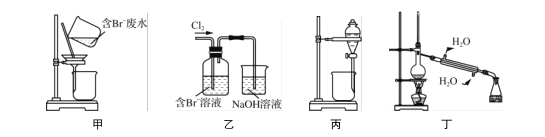
����˵����ȷ����(����)
A. �ü�װ�ù���ʱ���費�Ͻ���
B. ����װ�ý�Br������ΪBr2
C. ��װ��������ʮ���������CCl4������Ϊ���ܶ�С
D. ����װ�ö��������������ռ���ʮ�������ռ�Br2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ָ����Ӧ�����ӷ���ʽ��ȷ����
A. NO2ͨ��ˮ��:3NO2+H2O=2H++2NO2-+NO
B. Fe(OH)3����HI��Һ:Fe(OH)3+3H+=Fe3++3H2O
C. (NH4)2SO4��Һ�м���Ba(OH)2��Һ:NH4++SO42-+Ba2++OH-=BaSO4��+NH3��H2O
D. ��NaAlO2��Һ�е���NaHCO3��Һ������ɫ������AlO2-+HCO3-+H2O=Al(OH)3��+CO![]()
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ʽ̼��þ[4MgCO3��Mg(OH)2��4H2O]����Ҫ����������Ʒ��һ���ɰ���ʯ[��Ҫ�ɷ�ΪCaMg(CO3)2����������SiO2��Fe2O3��]Ϊԭ���Ʊ���ʽ̼��þ(���ұ���CaO������������0.43%)��ʵ���������£�
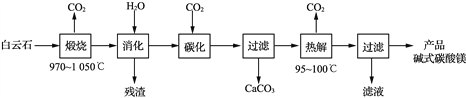
��1�� ��������ʱ������Ҫ��Ӧ�Ļ�ѧ����ʽΪ____________________________��
��2�����³�ѹ����̼������ʹþԪ��ת��ΪMg(HCO3)2����̼����ʱ�յ�pH�����ղ�Ʒ��CaO��������ʽ̼��þ���ʵ�Ӱ����ͼ1��ͼ2��ʾ��
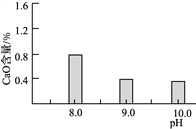
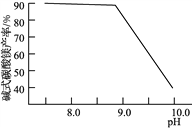
ͼ1��CaO������̼���յ�pH�Ĺ�ϵ�� ͼ2����ʽ̼��þ������̼���յ�pH�Ĺ�ϵ
��Ӧ������̼�����յ�pHԼΪ________����������Ҫ��Ӧ�Ļ�ѧ����ʽΪ______________________��____________________��
��ͼ2������pH��10.0ʱ��þԪ�ص���Ҫ������ʽ��____________(д��ѧʽ)��
��3�����Ƚ������ɼ�ʽ̼��þ�Ļ�ѧ����ʽΪ________________________________��
��4���ù���Ϊ�ﵽ�������������ѭ�����õ�������____________(д��ѧʽ)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ͨ����Ӧ �����Ʊ��л��м��������ᱽ����
�����Ʊ��л��м��������ᱽ����
��1�� Ni3����̬��������Ų�ʽΪ________��
��2�������ᱽ��������̼ԭ���ӻ����������________��1 mol�����ᱽ�������к���������ĿΪ________��
��3��Na��O��C��N����Ԫ�صĵ�һ�����ܴӴ�С��˳��Ϊ_________________________��
��4�� C2H5OH�ķе����![]() ��������Ϊ__________________��
��������Ϊ__________________��
��5�� Ni��Al�γɵ�һ�ֺϽ����������ɻ�������ҶƬ���侧���ṹ����ͼ��ʾ���úϽ�Ļ�ѧʽΪ________��
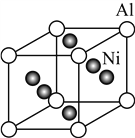
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Fe2O3+2Al![]() Al2O3+2Fe����������Ӧ������______���ڸ÷�Ӧ��______Ԫ�صĻ��ϼ����ߣ���Ԫ�ص�ԭ��______���ӣ���______���÷�Ӧ�У�Fe2O3������________��Ӧ��Al������______��Ӧ��______����������__�ǻ�ԭ����______���������_____�ǻ�ԭ���
Al2O3+2Fe����������Ӧ������______���ڸ÷�Ӧ��______Ԫ�صĻ��ϼ����ߣ���Ԫ�ص�ԭ��______���ӣ���______���÷�Ӧ�У�Fe2O3������________��Ӧ��Al������______��Ӧ��______����������__�ǻ�ԭ����______���������_____�ǻ�ԭ���
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com