
【题目】某废水中可能含有下列离子中的若干种:Fe3+、Al3+、Fe2+、Cu2+、Cl-、CO32-、NO3-、SO42-、SiO32-。现进行如下实验:
Ⅰ.取少量溶液,加入KSCN溶液,无明显变化。
Ⅱ.另取溶液加入少量盐酸,有无色气体生成,该无色气体遇空气变成红棕色。
Ⅲ.向Ⅱ中所得的溶液中加入BaCl2溶液,有白色沉淀生成。
Ⅳ.向Ⅱ中所得的溶液中加入过量浓氨水,仅有红褐色沉淀生成。过滤,在所得滤液中加入盐酸至酸性时,再加入氢氧化钠溶液,有蓝色沉淀生成。
请回答下列问题:
(1)该废水中一定含有的离子是_________________________。
(2)实验Ⅱ中加入少量盐酸生成无色气体的离子方程式是______________________。
(3)过滤除去Ⅳ中的蓝色沉淀,调整滤液的pH为10.7左右时,加入铝粉,反应产生氨气和氮气的体积比为1:4,其离子方程式为Al+NO3-+OH-→ AlO2-+NH3+N2+H2O(未配平)。还原产物是_________,若除去0.2 mol NO3-,要消耗铝________g。
【答案】Fe2+、Cu2+、NO3-、SO42- 3Fe2++NO3-+4H+=3Fe3++NO↑+2H2O NH3和N2 9.6
【解析】
I. 取少量溶液,加入KSCN溶液,无明显变化,证明溶液中不含Fe3+;
Ⅱ. 另取溶液加入盐酸,有无色气体生成,该无色气体遇空气变成红棕色,说明是一氧化氮被氧化为二氧化氮,证明原溶液中一定含有NO3和Fe2+,根据离子共存知,溶液中不能有CO32、SiO32;
Ⅲ. 向Ⅱ中所得溶液中加入BaCl2溶液,有白色沉淀生成,证明溶液中有SO42;
Ⅳ. 向Ⅱ中所得溶液中加入过量浓氨水,仅有红褐色沉淀生成,则生成氢氧化铁红褐色沉淀,溶液中没有Al3+,过滤,在所得溶液中加入盐酸至酸性时,再加入氢氧化钠溶液,有蓝色沉淀生成,则生成氢氧化铜沉淀,则溶液中含有Cu2+,据此分析解得。
I. 取少量溶液,加入KSCN溶液,无明显变化,证明溶液中不含Fe3+;
Ⅱ. 另取溶液加入盐酸,有无色气体生成,该无色气体遇空气变成红棕色,说明是一氧化氮被氧化为二氧化氮,证明原溶液中一定含有NO3和Fe2+,根据离子共存知,溶液中不能有CO32、SiO32;
Ⅲ. 向Ⅱ中所得溶液中加入BaCl2溶液,有白色沉淀生成,证明溶液中有SO42;
Ⅳ. 向Ⅱ中所得溶液中加入过量浓氨水,仅有红褐色沉淀生成,则生成氢氧化铁红褐色沉淀,溶液中没有Al3+,过滤,在所得溶液中加入盐酸至酸性时,再加入氢氧化钠溶液,有蓝色沉淀生成,则生成氢氧化铜沉淀,则溶液中含有Cu2+;
(1)由以上分析可知,该废水中一定含有的离子是Fe2+、Cu2+、NO3-、SO42-;
故答案为:Fe2+、Cu2+、NO3-、SO42-;
(2)实验II:另取溶液加入盐酸,有无色气体生成,该无色气体遇空气变成红棕色,说明是一氧化氮被氧化为二氧化氮,证明原溶液中一定含有NO3和Fe2+,NO3在酸性环境下具有强氧化性,能氧化Fe2+,生成NO和Fe3+、水,反应的离子方程式为:3Fe2++NO3-+4H+===3Fe3++NO↑+2H2O;
故答案为:3Fe2++NO3-+4H+=3Fe3++NO↑+2H2O;
(3)反应产生氨气和氮气的体积比为1:4,根据得失电子守恒、电荷守恒、元素守恒配平方程式为:16Al+9NO3+7OH=16AlO2+4N2↑+NH3↑+2H2O,含有元素化合价降低的生成物为还原产物,为NH3和N2;设除去0.2 mol NO3-,要消耗铝xg,根据方程式可列比例式,
16Al+9NO3+7OH=16AlO2+4N2↑+NH3↑+2H2O
16 9
x 0.2mol 则可得,![]() ,解得x=
,解得x=![]() ,则Al的质量为
,则Al的质量为![]() mol×27gmol1=9.6g;
mol×27gmol1=9.6g;
故答案为:NH3和N2;9.6。


 小学课时作业全通练案系列答案
小学课时作业全通练案系列答案 金版课堂课时训练系列答案
金版课堂课时训练系列答案科目:高中化学 来源: 题型:
【题目】A、B、C、D、E、F六种物质有如下转化关系,E为淡黄色粉末,通常用在呼吸面具中作为氧气的来源。

(1)A、C、E、F的化学式:
A______,C______,E______,F______。
(2)向饱和的C的溶液中通入足量CO2,会出现的现象是_____,有关反应的化学方程式为____。
(3)鉴别C与F溶液应选用的试剂是_____,有关反应的离子方程式为_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮的化合物应用广泛,但氮氧化物是重要的空气污染物,应降低其排放。
(1)用CO2和NH3可合成氮肥尿素[CO(NH2)2]
已知:①2NH3(g)+CO2(g)=NH2CO2NH4 (s) △H=-151.5 kJ·mol-1
②NH2CO2NH4(s)=CO(NH2)2(s)+H2O(g) △H=+120.5 kJ·mol-1
③H2O(l)=H2O(g) △H=+44 kJ·mol-1
用CO2和NH3合成尿素(副产物是液态水)的热化学方程式为______________________
(2)工业上常用如下反应消除氮氧化物的污染:CH4(g)+2NO2(g)![]() N2(g)+CO2(g)+2H2O(g) △H,在温度为T1和T2时,分别将0.40molCH4和0.9molNO2充入体积为1L的密闭容器中,n(CH4)随反应时间的变化如图所示:
N2(g)+CO2(g)+2H2O(g) △H,在温度为T1和T2时,分别将0.40molCH4和0.9molNO2充入体积为1L的密闭容器中,n(CH4)随反应时间的变化如图所示:
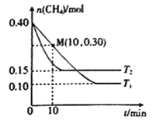
①根据图判断该反应的△H______0(填“>”、“<”或“=”)。
②温度为T1时,0~10min内NO2的平均反应速率v(NO2)=__________,反应的平衡常数K=_________ 。
③该反应达到平衡后,为在提高反应速率同时提高NO2的转化率,可采取的措施有______(填标号)。
A.改用高效催化剂 B.增加CH4的浓度 C.缩小容器的体积 D.升高温度
(3)利用原电池反应可实现NO2的无害化,总反应为6NO2+8NH3=7N2+12H2O,电解质溶液为HCl溶液,工作一段时间后,负极的电极反应式为________________。
(4)氮的一种氢化物HN3,其水溶液酸性与醋酸相似,则NaN3溶液中各离子浓度由大到小的顺序为________________;常温下,将amol/L的Ba(OH) 2 与bmol/L的HN3溶液等体积混合,充分反应后,溶液中存在2c(Ba2+)=c(N3-),则该溶液中c(HN3)=_________ mol/L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室可用KMnO4和浓盐酸反应制取氯气:KMnO4+HCl(浓)→KCl+MnCl2+Cl2↑+H2O(未配平)
(1)配平化学方程式,并用单线桥标出电子转移的方向和数目。________。
(2)将上述配平的化学方程式改写为离子方程式________。
(3)浓盐酸在反应中显示出来的性质是________。
①只有还原性 ②还原性和酸性 ③只有氧化性 ④氧化性和酸性
(4)若产生0.5mol Cl2,则被氧化的HCl ____mol,转移的电子的数目约为____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有AlCl3和MgSO4混合溶液,向其中不断加入NaOH溶液,得到沉淀的量与加入NaOH溶液的体积如图所示。原溶液中Cl-与SO42-的物质的量之比为( )
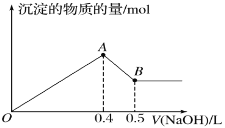
A.3∶1B.4∶1C.5∶1D.6∶1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素Q、R、T、W在元素周期表中的位置如图所示,其中T所处的周期序数与主族序数相等,下列说法正确的是( )
![]()
A.原子半径Q>R>T
B.原子序数比R多1的元素只能形成一种氢化物
C.W原子得电子能力强于Q原子,且可形成共价化合物QW2
D.与W同一主族的下一周期元素不可作为半导体材料
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢能的存储是氢能应用的主要瓶颈,开发新型储氢材料是氢能利用的重要研究方向。
(1)Ti(BH4)2是一种过渡元素硼氢化物储氢材料。
①基态Ti2+中含有的电子数为______,电子占据的最高能级是______,该能级具有的原子轨道数为______。
②BH4-中B原子的杂化方式是______。
(2)金属氢化物是具有良好发展前景的储氢材料。
①LiH中,离子半径:Li+______ H-(填“>”、“=”或“<”)。
②某储氢材料是短周期金属元素M的氢化物,M的部分电离能如下表所示:
I1/kJmol-1 | I2/kJmol-1 | I3/kJmol-1 | I4/kJmol-1 | I5/kJmol-1 |
738 | 1451 | 7733 | 10540 | 13630 |
该氢化物的化学式为______。
(3)液氨是富氢物质,是氢能的理想载体。
①NH3的相对分子质量小于PH3,但NH3的沸点却远高于PH3,其原因是 ______。
②NH3容易和分子中有空轨道的BF3反应形成新的化合物,该化合物的结构式为 ______。
(4)2008年,Yoon等人发现Ca与C60(分子结构如图1)生成的Ca32C60能大量吸附H2分子。
①C60晶体易溶于苯、CS2,C60是 ______ 分子(填“极性”或“非极性”)。
②1mol C60分子中,含有σ 键数目为 ______ 个(阿伏加德罗常数用NA表示)。

(5)某金属氢化物储氢材料的晶胞结构如图2所示,该金属氢化物的化学式为 ______,已知该晶体的密度为agcm-3,金属元素R的相对原子质量为M,阿伏加德罗常数为NA,则该晶胞的体积为 ______ cm3。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】黄铁矿烧渣(主要成分为Fe2O3、Fe3O4、FeO、SiO2等)是生产硫酸的工业废渣,其综合利用对环境保护具有现实意义。利用黄铁矿烧渣为原料制备高档颜料—铁红(Fe2O3)的流程如下:
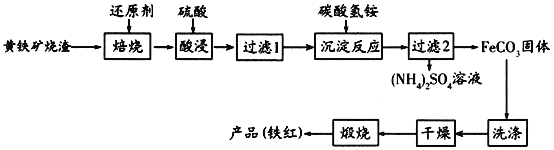
回答下列问题:
(1)“焙烧”时所添加的最佳还原剂是________(填序号)。
a.焦炭 b.硫黄 c.镁粉 d.锌粉
(2)“过滤1”后的滤液中溶质的主要成分是________________(填化学式)。
(3)“沉淀反应”时不宜混入过多空气,其原因为______________________(用离子方程式表示)。
(4)为检验FeCO3是否洗涤干净,可以向最后一次洗涤液中滴加________溶液。
(5)在空气中煅烧FeCO3生成铁红和另一种氧化物,反应的化学方程式为________。
(6)现有黄铁矿烧渣500t,铁元素的质量分数为16.8%,经过一系列转化后,得到90t铁红,该产品的产率为________。(提示:![]() )
)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列说法正确的是
A.标准状况下,11.2 L四氯化碳中含有的分子数0.5NA
B.常温常压下,18.0 g水所含的电子数为10 NA
C.300mL 0.1mol/L的NaCl的溶液含有0.03NA个NaCl分子
D.1.2 g熔融的NaHSO4含有阴阳离子总数为0.03NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com