
【题目】氢能的存储是氢能应用的主要瓶颈,开发新型储氢材料是氢能利用的重要研究方向。
(1)Ti(BH4)2是一种过渡元素硼氢化物储氢材料。
①基态Ti2+中含有的电子数为______,电子占据的最高能级是______,该能级具有的原子轨道数为______。
②BH4-中B原子的杂化方式是______。
(2)金属氢化物是具有良好发展前景的储氢材料。
①LiH中,离子半径:Li+______ H-(填“>”、“=”或“<”)。
②某储氢材料是短周期金属元素M的氢化物,M的部分电离能如下表所示:
I1/kJmol-1 | I2/kJmol-1 | I3/kJmol-1 | I4/kJmol-1 | I5/kJmol-1 |
738 | 1451 | 7733 | 10540 | 13630 |
该氢化物的化学式为______。
(3)液氨是富氢物质,是氢能的理想载体。
①NH3的相对分子质量小于PH3,但NH3的沸点却远高于PH3,其原因是 ______。
②NH3容易和分子中有空轨道的BF3反应形成新的化合物,该化合物的结构式为 ______。
(4)2008年,Yoon等人发现Ca与C60(分子结构如图1)生成的Ca32C60能大量吸附H2分子。
①C60晶体易溶于苯、CS2,C60是 ______ 分子(填“极性”或“非极性”)。
②1mol C60分子中,含有σ 键数目为 ______ 个(阿伏加德罗常数用NA表示)。

(5)某金属氢化物储氢材料的晶胞结构如图2所示,该金属氢化物的化学式为 ______,已知该晶体的密度为agcm-3,金属元素R的相对原子质量为M,阿伏加德罗常数为NA,则该晶胞的体积为 ______ cm3。
【答案】20 3d 5 sp3 < MgH2 氨气分子之间可以形成氢键 ![]() 非极性 90NA H2R
非极性 90NA H2R ![]()
【解析】
(1)①Ti是22号元素,原子核外有22个电子,Ti原子失去两个电子生成Ti2+,该离子核外有1s、2s、2p、3s、3p、3d电子,电子占据的最高能级是3d能级,该能级具有的原子轨道数为5;
②BH4-中B原子价层电子对个数是4且不含孤对电子对,根据价层电子对互斥理论判断B原子的杂化方式;
(2)①电子层结构相同的离子,离子半径随着原子序数增大而减小;
②根据表中数据知,M原子核外有2个电子,位于第IIA族,在化合物中呈现+2价,H为-1价,根据化合价判断化学键;
(3)①结构相似的氢化物,含有氢键的物质熔沸点较高;
②NH3容易和分子中有空轨道的BF3反应形成新的化合物,N原子和B原子之间存在配位键;
(4)①非极性分子的溶质极易溶于非极性分子的溶剂;
②根据图知,每个C原子含有σ 键个数=![]() ×3=1.5;
×3=1.5;
(5)该晶胞中H原子个数=2+4×![]() =4,R原子个数=1+8×
=4,R原子个数=1+8×![]() =2,H、R原子个数之比=4:2=2:1;根据密度和摩尔质量计算V=
=2,H、R原子个数之比=4:2=2:1;根据密度和摩尔质量计算V=![]() 。
。
(1)①Ti是22号元素,Ti原子核外有22个电子,Ti原子失去两个电子生成Ti2+,基态Ti2+中含有的电子数为20;该离子核外有1s、2s、2p、3s、3p、3d电子,电子占据的最高能级是3d能级,该能级具有的原子轨道数为5;
②BH4-中B原子价层电子对个数是4且不含孤对电子对,根据价层电子对互斥理论知B原子的杂化方式为sp3;
(2)①电子层结构相同的离子,离子半径随着原子序数增大而减小,所以离子半径:Li+<H-;
②根据表中数据知,M原子核外有2个电子,位于第IIA族,在化合物中呈现+2价,为Mg元素,H为-1价,该化合物化学键为MgH2;
(3)①结构相似的氢化物,含有氢键的物质熔沸点较高,氨气分子和磷化氢结构相似,但氨气中含有氢键,导致熔沸点升高;
②NH3容易和分子中有空轨道的BF3反应形成新的化合物,N原子和B原子之间存在配位键,其结构式为![]() ;
;
(4)①非极性分子的溶质极易溶于非极性分子的溶剂,C60晶体易溶于苯、CS2,C60是非极性分子;
②根据图知,每个C原子含有σ键个数=![]() ×3=1.5,1mol该物质中σ键个数=1.5×60×1mol×NA/mol=90NA;
×3=1.5,1mol该物质中σ键个数=1.5×60×1mol×NA/mol=90NA;
(5)该晶胞中H原子个数=2+4×![]() =4,R原子个数=1+8×
=4,R原子个数=1+8×![]() =2,H、R原子个数之比=4:2=2:1,所以其化学式为H2R,该晶胞体积=
=2,H、R原子个数之比=4:2=2:1,所以其化学式为H2R,该晶胞体积= cm3=
cm3=![]() cm3。
cm3。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】CO2和CH4催化重整可制备合成气,对减缓燃料危机具有重要意义,其反应历程示意图如图:

下列说法不正确的是( )
A.合成气的主要成分为CO和H2
B.①→②过程可表示为CO2+NiC=2CO+Ni
C.①→②过程吸收能量
D.Ni在该反应中做催化剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,在溶液中可发生以下反应:①![]() ②
②![]() ③
③![]() 由此判断下列说法正确的是()
由此判断下列说法正确的是()
A.铁元素在反应①中被还原,在③中被氧化
B.反应②中当有1molCl2被氧化时,有2molBr—被还原
C.氧化性强弱顺序为:![]()
D.还原性强弱顺序为:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某废水中可能含有下列离子中的若干种:Fe3+、Al3+、Fe2+、Cu2+、Cl-、CO32-、NO3-、SO42-、SiO32-。现进行如下实验:
Ⅰ.取少量溶液,加入KSCN溶液,无明显变化。
Ⅱ.另取溶液加入少量盐酸,有无色气体生成,该无色气体遇空气变成红棕色。
Ⅲ.向Ⅱ中所得的溶液中加入BaCl2溶液,有白色沉淀生成。
Ⅳ.向Ⅱ中所得的溶液中加入过量浓氨水,仅有红褐色沉淀生成。过滤,在所得滤液中加入盐酸至酸性时,再加入氢氧化钠溶液,有蓝色沉淀生成。
请回答下列问题:
(1)该废水中一定含有的离子是_________________________。
(2)实验Ⅱ中加入少量盐酸生成无色气体的离子方程式是______________________。
(3)过滤除去Ⅳ中的蓝色沉淀,调整滤液的pH为10.7左右时,加入铝粉,反应产生氨气和氮气的体积比为1:4,其离子方程式为Al+NO3-+OH-→ AlO2-+NH3+N2+H2O(未配平)。还原产物是_________,若除去0.2 mol NO3-,要消耗铝________g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素中:A是地壳中含量最高的元素;B比Ne的质子数多1个;C最外层电子数与其电子层数相等;D单质是半导体材料;E非金属性在同周期元素中最强。下列说法中正确的是
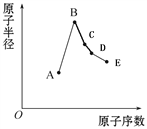
A. B离子的半径比C离子的半径小
B. C单质与A或E单质形成的化合物均为离子化合物
C. A、B两单质反应可得到两种不同的离子化合物
D. B最高价氧化物对应的水化物与0.1mol D单质充分反应放出4.48L气体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某无色溶液100mL,其中可能含Fe3+、Al3+、Na+、Mg2+、Cu2+、NH4+、K+、CO32-、SO42-等离子中的几种,为分析其成分,取此溶液分别进行了四个实验,其操作和有关现象如图所示。
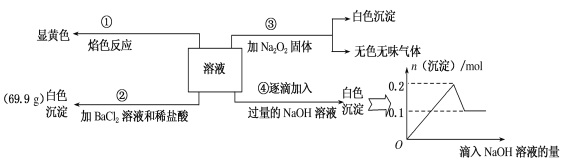
请回答下列问题:
(1)焰色反应是___(填“物理”或“化学”)变化;实验③中产生的无色无味气体是___(填化学式)。
(2)原溶液中一定存在的离子有___,一定不存在的离子有____。
(3)若溶液中K+物质的量为0.04mol,则c(Na+)=___mol/L。
(4)将一定量Fe2O3和Al2O3混合物溶于100mL稀硫酸中,向反应后的溶液中缓慢加入NaOH溶液,加入NaOH溶液的体积与生成沉淀的质量关系如图所示,试回答:
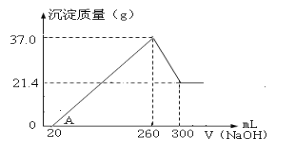
①混合物中含Fe2O3的质量为___g;
②所用硫酸溶液物质的量浓度为___mol/L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】草酸亚铁晶体(FeC2O4·2H2O,相对分子质量为180)呈淡黄色,可用作照相显影剂。某实验小组对其进行了一系列探究。
I.纯净草酸亚铁晶体热分解产物的探究。
(1)气体产物成分的探究。小组成员采用如图装置(可重复选用)进行实验:
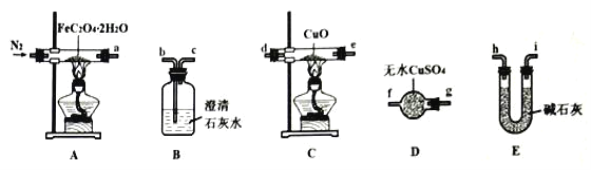
①装置D的名称为____。
②按照气流从左到右的方向,上述装置的连接顺序为____→尾气处理装置(填图中各仪器接口的字母编号)。
③实验前先通入一段时间N2,其目的为____。
④实验证明了气体产物中含有CO,依据的实验现象为_____。
(2)固体产物成分的探究。充分反应后,A处反应管中残留黑色固体。小组成员设计实验证明了其成分只有FeO,其实验操作及现象为:___。
(3)依据(1)和(2)结论,可知A处反应管中发生反应的化学方程式为:___。
Ⅱ.草酸亚铁晶体样品纯度的测定
工业制得的草酸亚铁晶体中常含有FeSO4杂质,测定其纯度的步骤如下(杂质不参与反应):
步骤1:称取2g草酸亚铁晶体样品并溶于稀H2SO4中,配成250mL溶液。
步骤2:取上述溶液25.00mL,向其中加入0.01mol·L1KMnO4溶液,恰好完全反应时消耗 KMnO4溶液30mL。
[已知:FeC2O4+KMnO4+H2SO4→Fe2(SO4)3+CO2↑+MnSO4+K2SO4+H2O(未配平)]
(4)草酸亚铁晶体样品的纯度为____;若步骤1配制溶液时部分Fe2+被氧化,则测定结果将____(填“偏高”、“偏低”或“不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
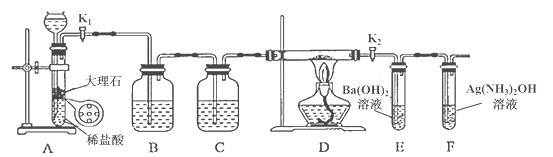
【题目】为探究Na与CO2反应的产物,某化学兴趣小组按如图所示装置进行实验。
己知:CO+2Ag(NH3)2OH=2Ag↓+ (NH4)2CO3+2NH3
回答下列问题:
(1)B中的溶液为______________。
(2)先称量硬质玻璃管的质量为ml g,将样品装入硬质玻璃管中,称得样品和硬质玻璃管的总质量是m2 g。再进行下列实验操作,其正确顺序是____________(填标号);重复上述操作步骤,直至硬质玻璃管恒重,称得质量为m3 g。
a.点燃酒精灯,加热 b.熄灭酒精灯 c.称量硬质玻璃管
d.打开K1和K2,通入CO2至E中出现浑浊 e.关闭K1和K2 f.冷却到室温
(3)加热硬质玻璃管一段时间,观察到以下现象:
①钠块表面变暗,熔融成金属小球;
②继续加热,钠迅速燃烧,产生黄色火焰。反应完全后,管中有大量黑色物质;
③F中试管内壁有银白物质产生。
产生上述②现象的原因是____________________________________________________;
(4)探究固体产物中钠元素的存在形式
假设一:只有Na2CO3; 假设二:只有Na2O; 假设三:Na2O和Na2CO3均有;
完成下列实验设计,验证上述假设:
步骤 | 操作和现象 | 结论 |
1 | 将硬质玻璃管中的固体产物溶于水后过滤; | 假设一成立 |
2 | 往步骤1所得滤液中_________________________________; 现象:____________________________________。 |
(5)根据上述实验现象及下表实验数据,写出Na与CO2反应的总化学方程式_____________。
m1 | m2 | m3 |
66.7g | 69.0g | 72.1g |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学生欲配制0.2mol/L的CuSO4溶液98mL,并探究硫酸铜的性质。实验室有两种不同的试剂可供选用:① CuSO4·5H2O晶体;②16%的CuSO4溶液 (ρ=2.3 g/mL)。回答下列问题:
(1)配制该硫酸铜溶液应选用的玻璃仪器除量筒、烧杯和玻璃棒外,还有________。
(2)若取用①来配置该硫酸铜溶液,需用托盘天平称量_______g;若取用②来配置,所选用硫酸铜溶液的体积为_______mL。
(3)若取用②来配置,下列操作会使得所配硫酸铜溶液浓度偏低的是____(填编号)。
a.量取硫酸铜溶液的量筒未用蒸馏水洗涤 b.容量瓶中有少量水
c.定容摇匀时,液面下降又加水 d.定容时仰视刻度线
(4)取所配硫酸铜溶液,往其中加入BaCl2溶液,观察有白色沉淀出现。如何证明所取溶液中的硫酸根离子沉淀完全?________。
(5)课堂上,老师演示了金属钠与CuSO4溶液反应的实验,大家都观察到有蓝色沉淀生成,用化学反应方程式解释原因_________。个别较细心的同学还发现生成的蓝色沉淀中混有少量黑色难溶物,而所使用的药品均没有问题,该黑色难溶物是________(填化学式),猜测生成该黑色难溶物的原因是________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com