
分析 (1)增加H2,反应物浓度增大,平衡正向移动;
(2)缩小反应容器的容积,保持温度不变,浓度均增大,压强增大,平衡不移动;
(3)保持反应容器的容积和温度不变,通入H2,反应物浓度增大,平衡正向移动;
(4)该反应为吸热反应,保持反应容器的容积不变,升高温度,平衡正向移动.
解答 解:(1)增加H2,反应物浓度增大,平衡正向移动,H2的转化率增大,故答案为:正向移动;增大;
(2)缩小反应容器的容积,保持温度不变,浓度均增大,压强增大,平衡不移动,c(H2) 增大,故答案为:不移动;增大;
(3)保持反应容器的容积和温度不变,通入H2,反应物浓度增大,平衡正向移动,则c(HI)增大,故答案为:正向移动;增大;
(4)该反应为吸热反应,保持反应容器的容积不变,升高温度,平衡正向移动,c(H2)减小,故答案为:正向移动;减小.
点评 本题考查化学平衡的移动,为高频考点,把握温度、浓度对平衡移动的影响为解答本题的关键,侧重分析与应用的考查,注意平衡移动原理的应用,题目难度不大.


科目:高中化学 来源: 题型:实验题
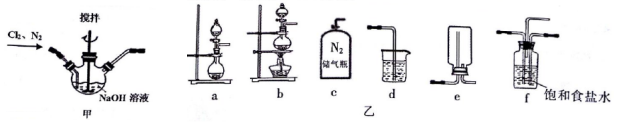
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 溶液的pH:①>②>③ | |
| B. | 整个过程中Fe2(SO4)3溶液可以循环利用 | |
| C. | 溶液②转化为溶液③发生反应的离子方程式为4H++4Fe2++O2=4Fe3++2H2O | |
| D. | 向②溶液中滴加KSCN溶液,溶液可能变为血红色 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.4mol | B. | 0.6mol | C. | 0.8mol | D. | 2mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 同温同压下,只要物质比例适当,从正、逆方向都可以建立同一平衡状态 | |
| B. | 图甲表示的反应为H2(g)+I2(g)?2HI(g) | |
| C. | 图甲中H2的转化率+图乙中HI的转化率=100% | |
| D. | 相同条件下,分别从正、逆方向建立等同的平衡状态,所需时间相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 小苏打溶液中:c(Na+)+c(H+)=c(HCO3-)+c(CO32-)+c(OH-) | |
| B. | CH3COONa溶液中:c(CH3COO-)>c(Na+) | |
| C. | 物质的量浓度相等的CH3COOH溶液和CH3COONa溶液等体积混合:c(CH3COO-)+2c(OH-)=2c(H+)+c(CH3COOH) | |
| D. | 常温下,0.1mol/L的NaHA溶液,其pH=4,则c(HA-)>c(H+)>c(H2A)>c(A2-) |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com