
用下列装置进行相应实验(部分夹持仪器未画出),能达到实验目的的是( )
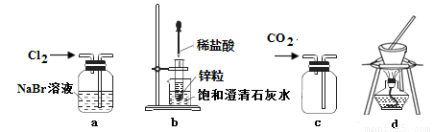
A.装置a可用于比较Cl2和Br2的氧化性强弱
B.装置b可用于验证锌粒与稀盐酸反应放热
C.装置c可用于排空气法收集CO2
D.装置d可用于蒸干饱和食盐水获得NaCl晶体
科目:高中化学 来源:2015-2016学年福建省高二上学期期中测试化学试卷(解析版) 题型:填空题
(1)已知H+(aq)+OH-(aq)===H2O(l) ΔH=-57.3 kJ·mol-1。用50mL0.50 mol·L?1盐酸与50mL0.55 mol·L?1 NaOH溶液在如图所示的装置中进行中和反应。通过测定反应过程中所放出的热量可计算中和热。回答下列问题:
①从实验装置上看,图中尚缺少的一种玻璃仪器是______________________。
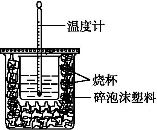
②为了测定酸碱反应的中和热,计算时至少需要的数据是
a.酸的浓度和体积 b.碱的浓度和体积 c.比热容
d.反应后溶液的质量 e.生成水的物质的量
f.反应前后温度的变化 g.操作所需时间
A.abcf B.acde C.cdef D.全部
③若通过该实验测定中和热的ΔH,其结果常常大于-57.3 kJ·mol-1,其原因可能:___________________________。
④用相同浓度和体积的氨水(NH3·H2O)代替NaOH溶液进行上述实验,测得的中和热的数值会________(填“偏大”、“偏小”或“无影响”)。
(2) 已知热化学方程式:
2H2O(l) = 2H2(g)+O2(g) ΔH=+571.6 kJ·mol?1
2H2(g)+O2(g)=2H2O(g) ΔH=-483.6 kJ·mol?1
当1 g液态水变为气态水时,对其热量变化的下列描述:①放出热量;②吸收热量;③2.44 kJ;④4.88 kJ;⑤88 kJ 。其中正确的是( )
(3) 已知CH3OH(l),HCHO(g)的燃烧热△H分别为-726.64 kJ·mol?1 和-563.58 kJ·mol?1,则CH3OH(l)与O2(g)反应生成HCHO(g)和H2O(l) 的热化学反应方程式:_________________________。
查看答案和解析>>
科目:高中化学 来源:2016届江苏省淮安市高三上学期10月阶段测化学试卷(解析版) 题型:选择题
下列有关物质应用的说法不正确的是
A、铁制容器可盛装冷的浓硫酸,因为常温下铁和浓硫酸不反应
B、Na2O2用作呼吸面具的供氧剂
C、欲鉴别FeCl2溶液、AlCl3溶液和AgNO3溶液,向3种待测液中分别滴加足量氨水
D、铝热反应需提供一定的能量引发,因为铝热反应为吸热反应
查看答案和解析>>
科目:高中化学 来源:2016届辽宁师范大学附属中学高三上学期期中考试化学试卷(解析版) 题型:选择题
对下列化学用语或化学原理的理解和描述均正确的是( )
A.电子式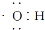 可以表示羟基,也可以表示氢氧根离子
可以表示羟基,也可以表示氢氧根离子
B.比例模型 可以表示二氧化碳分子,也可以表示水分子
可以表示二氧化碳分子,也可以表示水分子
C.明矾能水解生成Al(OH)3胶体,可用作饮用水杀菌
D.原子结构示意图 可以表示12C,也可以表示14C
可以表示12C,也可以表示14C
查看答案和解析>>
科目:高中化学 来源:2016届江西省南昌市高三上学期第三次考试化学试卷(解析版) 题型:选择题
某消毒液的主要成分为NaClO,还含有一定量的NaOH。下列用来解释事实的方程式中,不合理的是(已知:饱和NaClO溶液的pH约为11)
A.该消毒液可用NaOH溶液吸收Cl2制备:Cl2+2OH-=ClO-+Cl-+H2O
B.该消毒液的pH约为12:ClO-+H2O HClO+OH-
HClO+OH-
C.该消毒液与洁厕灵(主要成分为HCl)混用,产生有毒Cl2:2H++Cl-+ClO-=Cl2↑+H2O
D.该消毒液加白醋生成HClO,可增强漂白作用:CH3COOH+ClO-=HClO+CH3COO-
查看答案和解析>>
科目:高中化学 来源:2016届江西上高第二中学高三12月月考理科综合化学试卷(解析版) 题型:选择题
北京大学和中国科学院的化学工作者已成功研制出碱金属与C60形成的球碳盐K3C60,实验测知该物质属于离子化合物,具有良好的超导性。下列有关分析正确的是( )
A.K3C60中只有离子键 B.K3C60中不含共价键
C.该晶体在熔融状态下能导电 D.C60与12C互为同素异形体
查看答案和解析>>
科目:高中化学 来源:2016届黑龙江哈尔滨师大附中高三上学期期中考试化学试卷(解析版) 题型:实验题
某校化学兴趣小组设计了图示实验装置(图中省略了夹持仪器)来测定某铁碳合金中铁的质量分数。

(1)m克铁碳合金中加入过量浓硫酸,未点燃酒精灯前,A、B均无明显现象,其原因是① 常温下碳与浓硫酸不反应;② 。
(2)写出加热时A中碳与浓硫酸发生反应的化学方程式 。
(3)B中的现象是: ;C的作用是: 。
(4)待A中不再逸出气体时,停止加热,拆下E并称重,E增重bg。则铁碳合金中铁的质量分数
为 (写化简后的表达式)。
(5)甲同学认为利用此装置测得铁的质量分数偏大,请你写出可能的原因: 。
(6)最后对所得测量结果进行评价,小组内有同学提出,本套装置在设计上存在多处缺陷而导致实验结果不准确,其中会导致铁质量分数测量值偏低是(任答一条即可) 。
查看答案和解析>>
科目:高中化学 来源:2016届福建省高三上学期期中考试化学试卷(解析版) 题型:实验题
某小组同学为比较酸性条件下NO3-、SO42-、Fe3+的氧化性强弱,设计如下实验(夹持仪器已略去,装置的气密性已检验)。

实验记录如下:
实验操作 | 实验现象 | |
I | 打开活塞c,将过量稀HNO3加入装置B中,关闭活塞c | B中浅绿色溶液最终变为黄色。 |
II | 用注射器取出少量B装置中的溶液,加入KSCN溶液 | 溶液变为红色。 |
III | 打开活塞b,向A装置中加入足量硫酸,关闭活塞b | A中产生气体;B中有气泡,液面上有少量红棕色气体生成。 |
IV | 一段时间后,用注射器取出少量B装置中的溶液,…… | …… |
V | 打开活塞a,通入一段时间空气 | ———— |
请回答下列问题:
(1)实验I中,发生反应的离子方程式是 。
(2)实验IV的后续操作是 ,观察到的现象是 。
(3)由实验得出的结论:酸性条件下氧化性由大到小的顺序是 。
(4) 实验操作V的目的是 。
(5)实验操作III,开始时B中溶液的颜色并无明显变化,此时溶液中发生反应的离子方程式是 。
查看答案和解析>>
科目:高中化学 来源:2015-2016浙江宁波效实中学高二上期中考试化学试卷卷(解析版) 题型:选择题
有一可逆反应2A(g)+3B(g) 4C(g)+D(g),已知起始浓度c(A)=2 mol/L,c(B)=3 mol/L,c(C)=c(D)=0,反应开始20 min后达到平衡状态,此时D的平衡浓度为0.5 mol/L,则下列说法不正确的是
4C(g)+D(g),已知起始浓度c(A)=2 mol/L,c(B)=3 mol/L,c(C)=c(D)=0,反应开始20 min后达到平衡状态,此时D的平衡浓度为0.5 mol/L,则下列说法不正确的是
A.前20 min的平均反应 速率v(C)=0.1 mol/(L·min)
速率v(C)=0.1 mol/(L·min)
B.A的转化率为50%
C.C的平衡浓度c(C)=4 mol/L
D.B的平衡浓度c(B)=1.5 mol/L
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com