
| A、食物的酸碱性是按食物在体内代谢最终产物的性质来分类的 |
| B、酸性食物在体内代谢后可形成阴离子酸根 |
| C、碱性食物在体内代谢后可形成含金属阳离子的碱性物质 |
| D、某些水果酸味很强,它们是酸性食物 |


科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
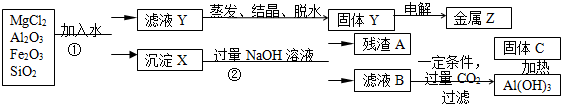
查看答案和解析>>
科目:高中化学 来源: 题型:
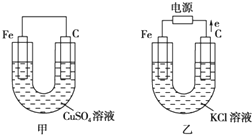 根据如图所提供的信息,在反应一段时间后:
根据如图所提供的信息,在反应一段时间后:查看答案和解析>>
科目:高中化学 来源: 题型:
| A、混合溶液中由水电离出的c(OH?)<0.2mol?L-1HX溶液中由水电离出的c(H+) |
| B、c(Na+)=c(X?)+c(HX)=0.2mol?L-1 |
| C、c(Na+)-c(X?)=9.9×10-7mol?L-1 |
| D、c(OH?)+c(HX)=c(H+)=1×10-8mol?L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、蛋白溶液中加入食盐变浑浊 |
| B、用稀的福尔马林浸泡种子 |
| C、打针时用酒精消毒 |
| D、用波尔多液(由CuSO4溶液、生石灰和水制成)防止作物虫害 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、用粮食酿酒的过程中,不可能生成乙酸 |
| B、乙醇和乙酸互为同分异构体 |
| C、氨基酸、蛋白质和纤维素均属于高分子化合物 |
| D、乙烯能使溴的四氯化碳溶液褪色,与乙烯分子含有碳碳双键有关 |
查看答案和解析>>
科目:高中化学 来源: 题型:
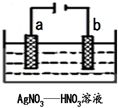 金属冶炼和处理常涉及许多反应.
金属冶炼和处理常涉及许多反应.查看答案和解析>>
科目:高中化学 来源: 题型:
| c(CH3COO-) |
| c(Na+) |
| A、升温 |
| B、加水稀释 |
| C、加少量的KOH固体 |
| D、加少量固体Na2CO3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com