
【题目】下列指定反应的离子方程式错误的是( )
A.AgCl悬浊液中加入KI,沉淀由白色变为黄色:AgCl+I-=AgI+C1-
B.用惰性电极电解MgCl2溶液:2Cl-+2H2O![]() H2↑+Cl2↑+2OH-
H2↑+Cl2↑+2OH-
C.CaCO3与FeCl3溶液反应:3CaCO3+2Fe3++3H2O=3Ca2++2Fe(OH)3↓+3CO2↑
D.向沸水中滴加饱和氯化铁溶液得到红褐色液体:Fe3++3H2O![]() Fe(OH)3(胶体) +3H+
Fe(OH)3(胶体) +3H+
【答案】B
【解析】
A.AgCl悬浊液中加入KI,可以生成溶解度更小的AgI,白色沉淀变为黄色,离子方程式为:AgCl+I-=AgI+C1-,A正确;
B.用惰性电极电解MgCl2溶液,会生成Mg(OH)2, Mg(OH)2不能拆,离子方程式为:Mg2++2Cl-+2H2O![]() H2↑+Cl2↑+Mg(OH)2
H2↑+Cl2↑+Mg(OH)2![]() ,B错误;
,B错误;
C.Fe3+水解可生成H+,Fe3++3H2O![]() Fe(OH)3+3H+,H+与
Fe(OH)3+3H+,H+与![]() 反应,可促进CaCO3
反应,可促进CaCO3![]() Ca2++
Ca2++![]() 平衡向正向移动,直至反应完全。总反应为3CaCO3+2Fe3++3H2O=3Ca2++2Fe(OH)3↓+3CO2↑,C正确;
平衡向正向移动,直至反应完全。总反应为3CaCO3+2Fe3++3H2O=3Ca2++2Fe(OH)3↓+3CO2↑,C正确;
D.向沸水中滴加饱和氯化铁溶液,沸水温度高,可促进Fe3+水解,生成Fe(OH)3胶体,离子反应为:Fe3++3H2O![]() Fe(OH)3(胶体) +3H+,D正确;
Fe(OH)3(胶体) +3H+,D正确;
故选B。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】NA表示阿伏加德罗常数,下列叙述正确的是( )
A.18g H216O 和20g H218O 含有的质子数均为10NA
B.1L 1mol/L的KAl(SO4)2 溶液中阳离子总数为2NA
C.0.2mol的铁与足量的稀硝酸反应,生成氢气的分子数目为0.3NA
D.反应N2+3H2 ![]() 2NH3 达平衡时,每消耗3molH2同时有2NA 个N-H 键断裂
2NH3 达平衡时,每消耗3molH2同时有2NA 个N-H 键断裂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关实验装置进行的相应实验,能达到实验目的的是:
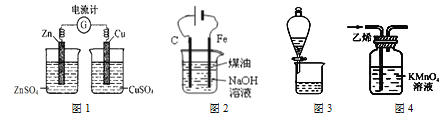
A.用图1装置用电流计检验电流的方向
B.用图2装置制备Fe(OH)2并能较长时间观察其颜色
C.用图3装置可分离CH3COOC2H5和饱和碳酸钠溶液
D.用图4装置除去C2H4中少量SO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中不正确的是( )
A.ABn型分子中,若中心原子没有孤对电子,则ABn为空间对称结构,属于非极性分子
B.SO3、![]() 、
、![]() 、
、![]() 的空间构型均为三角锥形
的空间构型均为三角锥形
C.NH3、![]() 、H2O、H3O+、CH4中的N、O、C原子均是采取sp3杂化的
、H2O、H3O+、CH4中的N、O、C原子均是采取sp3杂化的
D.配合物[Cu(H2O)4]SO4中,中心离子是Cu2+,配位体是H2O,配位数是4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某课外活动小组根据镁与CO2的反应设计实验探究镁与NO2的反应。
甲同学推测产物是MgO和N2;
乙同学推测产物除了MgO和N2外,固体中还可能含有Y。
该小组同学设计了以下装置探究镁与NO2反应的固体产物,并测定其组成。
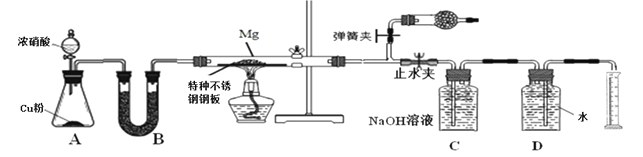
(1)实验开始时,先关闭止水夹后打开弹簧夹,再打开分液漏斗活塞,当硬质玻璃管充满红综色气体后,打开止水夹,关闭弹簧夹,最后点燃酒精灯。这样做的目的是___________________________________________________________
(2)装置B中的试剂可以选用________
A、浓硫酸 B、无水氯化钙 C、五氧化二磷 D、碱石灰
(3)装置C中盛装氢氧化钠溶液的作用是:___________________________________
(4)为保证生成气体体积的准确性,读取量筒刻度时应注意的问题是①气体恢复至室温再读数;②_______________________________;③______________________________。
(5)实验结束后,同学们将固体产物取出与水反应,发现有刺激性气味的气体产生,该气体能使湿润的石蕊试纸变蓝。说明乙组同学推测正确,请写出Y与水反应的化学方程式__________________________________
(6)若初始加入镁粉质量为3.6 g,在足量的NO2中充分反应后 ,收集到N2体积为448mL (标准状况),则产物中MgO的质量是_________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学探究Cu与NO的反应,查阅资料:①Cu与NO反应可生成CuO和N2,②酸性条件下,NO或NO2–都能与MnO4–反应生成NO3–和Mn2+
(1)实验室利用Cu和稀HNO3制备NO,写出反应的化学方程式_____________。
(2)选用如图所示装置完成Cu与NO的实验。(夹持装置略) 实验开始前,向装置中通入一段时间的N2。回答下列问题:

①使用铜丝的优点是_____________________装置E的作用为_______________。
②装置C中盛放的药品可能是_________;
③装置D中的现象是_______________;装置F中反应的离子方程式是_______________。
(3)测定NaNO2和NaNO3 混合溶液中NaNO2的浓度。 取25.00mL混合溶液于锥形瓶中,用0.1000mol·L-1酸性KMnO4溶液进行滴定,实验所得数据如下表所示:
滴定次数 | 1 | 2 | 3 | 4 |
消耗KMnO4溶液体积/mL | 20.90 | 20.12 | 20.00 | 19.88 |
①第一次实验数据出现异常,造成这种异常的原因可能是_________(填字母代号)。
a.锥形瓶洗净后未干燥
b.酸式滴定管用蒸馏水洗净后未用标准液润洗
c.滴定终点时仰视读数
d.酸性KMnO4溶液中含有其他氧化性试剂
e.锥形瓶洗净后用待测液润洗
②酸性KMnO4溶液滴定亚硝酸钠溶液的离子方程式为___________________。
③NaNO2 的物质的量浓度为__________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】燃料乙醇的生产过程示意图如图所示:
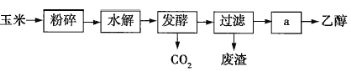
(1)粉碎玉米的目的是__________________________________。
(2)玉米中所含有机物的主要成分是________(填名称)。
(3)步骤a的操作是________(填名称)。
A.蒸发 B.萃取 C.蒸馏 D.分液
(4)发酵产生的![]() 的纯度可达99%,可回收利用,请列举出它的两种用途: ________________________。
的纯度可达99%,可回收利用,请列举出它的两种用途: ________________________。
(5)用葡萄糖制乙醇的化学方程式可表示为![]() 。根据上述反应式,可计算出100kg淀粉在理论上生产的无水乙醇为________kg。
。根据上述反应式,可计算出100kg淀粉在理论上生产的无水乙醇为________kg。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三硫代碳酸钠(Na2CS3)在农业上用作杀菌剂和杀线虫剂,在工业上用于处理废水中的重金属离子。某化学兴趣小组对Na2CS3的一些性质进行了探究性实验。
实验I.探究Na2CS3的性质:
步骤 | 操作及现象 |
① | 取少量Na2CS3固体溶于蒸馏水中,配制成溶液并分成两等份 |
② | 向其中一份溶液中滴加几滴酚酞试剂,溶液变成红色 |
③ | 向另一份溶液中滴加硫酸酸化的KMnO4溶液,紫色褪去 |
(1)H2CS3是___(填“强”或“弱”)酸。
(2)已知步骤③中反应的氧化产物是SO42-,则该反应的离子方程式为___。
(3)某同学取步骤③反应后所得溶液于试管中,滴加足量盐酸和氯化钡溶液,他认为通过测定产生的白色沉淀的质量即可求出实验中所用的Na2CS3的质量。你是否同意他的观点并说明理由:___。
实验Ⅱ.测定Na2CS3溶液的浓度:
按如图所示装置进行实验:将50.0mLNa2CS3溶液置于三颈烧瓶中,打开仪器M的活塞,滴入足量2.0molL-1的稀H2SO4,关闭活塞。

已知:CS32-+2H+=CS2+H2S↑,CS2和H2S均有毒。(CS2不溶于水,沸点为46℃,与CO2的某些性质相似,与NaOH作用生成Na2COS2和H2O)
(4)仪器M的名称是___。反应开始前需要先通入一段时间N2,其作用为___。
(5)B中发生反应的离子方程式为___。
(6)反应结束后打开活塞K,再缓慢通入一段时间的热N2,其目的是___。
(7)为了计算三硫代碳酸钠溶液的浓度,可通过测定B中生成沉淀的质量来计算。称量B中沉淀质量之前需要进行的实验操作是___。若B中生成沉淀的质量为8.4g,则Na2CS3溶液的物质的量浓度是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列事实不能用勒夏特列原理解释的是
A. 开启啤酒瓶后,瓶中马上泛起大量泡沫
B. H2、I2、HI混合气体加压后颜色变深
C. 红棕色的NO2加压后颜色先变深再变浅
D. 工业上生产硫酸的过程中使用过量的空气,以提高二氧化硫的利用率
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com