
【题目】下列事实不能用勒夏特列原理解释的是
A. 开启啤酒瓶后,瓶中马上泛起大量泡沫
B. H2、I2、HI混合气体加压后颜色变深
C. 红棕色的NO2加压后颜色先变深再变浅
D. 工业上生产硫酸的过程中使用过量的空气,以提高二氧化硫的利用率
【答案】B
【解析】
如果改变影响平衡的1个条件,平衡就向能够减弱这种改变的方向进行,中这就是勒夏特列原理,该原理适用于所有的平衡体系。
A、开启啤酒瓶后,越强减小,气体的溶解度减小,因此瓶中马上泛起大量泡沫,A可以用勒夏特列原理解释;
B、反应H2+I2![]() 2HI是体积不变的可逆反应,因此H2、I2、HI混合气体加压后平衡不移动,但单质碘的浓度增大,因此颜色变深,B不能用勒夏特列原理解释;
2HI是体积不变的可逆反应,因此H2、I2、HI混合气体加压后平衡不移动,但单质碘的浓度增大,因此颜色变深,B不能用勒夏特列原理解释;
C、NO2存在平衡关系2NO2![]() N2O4,因此红棕色的NO2加压后平衡向正反应方向移动,所以颜色先变深再变浅,C可以用勒夏特列原理解释;
N2O4,因此红棕色的NO2加压后平衡向正反应方向移动,所以颜色先变深再变浅,C可以用勒夏特列原理解释;
D、SO2与氧气反应的方程式为2SO2+O2![]() 2SO3,增大氧气的浓度平衡向正反应方向移动,因此SO2的转化率增大,D可以用勒夏特列原理解释.
2SO3,增大氧气的浓度平衡向正反应方向移动,因此SO2的转化率增大,D可以用勒夏特列原理解释.
答案选B。


 夺冠金卷全能练考系列答案
夺冠金卷全能练考系列答案科目:高中化学 来源: 题型:
【题目】在常温常压下,已知:
①4Fe(s)+3O2(g)= 2Fe2O3(s) ΔH1
②4Al(s)+3O2(g)= 2Al2O3(s) ΔH2
③2Al(s)+Fe2O3(s)= Al2O3(s)+2Fe(s) ΔH3
则ΔH3与ΔH1、ΔH2之间的关系正确的是
A. ΔH3=![]() (ΔH1+ΔH2) B. ΔH3=(ΔH2-ΔH1)
(ΔH1+ΔH2) B. ΔH3=(ΔH2-ΔH1)
C. ΔH3=2(ΔH1+ΔH2) D. ΔH3=![]() (ΔH2-ΔH1)
(ΔH2-ΔH1)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中和热的测定是高中化学中重要的定量实验。取50mL、0.55mol/L的NaOH溶液与50mL、0.25mol/L的H2SO4溶液置于如图所示的装置中进行中和热的测定实验,回答下列问题:
(1)从如图所示实验装置看,其中尚缺少的一种玻璃用品是_____________,除此之外,装置的一个明显错误是___________________________________________________。

(2)NaOH溶液稍过量的原因是_______________________________________________。
(3)若改用60mL、0.25mol/L的H2SO4溶液和50mL、0.55mol/L的NaOH溶液进行反应,与上述实验相比,所放出的热量_____________(填“相等”或“不相等”),若实验操作均正确,则所求中和热_______________(填“相等”或“不相等”)。
(4)倒入NaOH溶液的正确操作是__________
A.沿玻璃棒缓慢倒入 B.分三次少量倒入 C.一次性迅速倒入
(5)实验数据如下表:
温度 实验次数 | 起始温度t1/℃ | 终止温度t2/℃ | 温度差平均值 (t2-t1)/℃ | ||
H2SO4 | NaOH | 平均值 | |||
1 | 26.2 | 26.0 | 26.1 | 29.5 | |
2 | 27.0 | 27.4 | 27.2 | 32.3 | |
3 | 25.9 | 25.9 | 25.9 | 29.2 | |
4 | 26.4 | 26.2 | 26.3 | 29.8 | |
①近似认为0.55mol/L NaOH溶液和0.25mol/L H2SO4溶液的密度都是1g/cm3,中和后生成溶液的比热容c=4.18J/(g℃),则中和热△H=__________(取小数点后一位)。
②上述实验的结果与57.3kJ/mol有偏差,产生偏差的原因可能是____________。
A.实验装置保温、隔热效果差
B.用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度
C.做实验的当天室温较高
D.量取H2SO4时仰视读数
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一密闭容器中发生反应:2A(g)+2B(g)![]() C(s)+3D(g) ΔH<0,达到平衡时采取下列措施,可以使正反应速率v正增大、D的物质的量浓度c(D)增大的是( )
C(s)+3D(g) ΔH<0,达到平衡时采取下列措施,可以使正反应速率v正增大、D的物质的量浓度c(D)增大的是( )
A. 移走少量C B. 扩大容积,减小压强
C. 缩小容积,增大压强 D. 容积不变,充入“惰”气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在容积为2 L的密闭容器中,有反应mA(g)+nB(g) ![]() pC(g)+qD(g),经过5 min达到平衡,此时各物质的变化为A物质的量浓度减少a mol·L-1,B的平均反应速率v(B)=a/15 mol·L-1·min-1,C物质的量浓度增加2a/3 mol·L-1,这时若增大系统压强,发现A与C的百分含量不变,则m∶n∶p∶q为( )
pC(g)+qD(g),经过5 min达到平衡,此时各物质的变化为A物质的量浓度减少a mol·L-1,B的平均反应速率v(B)=a/15 mol·L-1·min-1,C物质的量浓度增加2a/3 mol·L-1,这时若增大系统压强,发现A与C的百分含量不变,则m∶n∶p∶q为( )
A. 3∶1∶2∶2B. 1∶3∶2∶2C. 1∶3∶2∶1D. 1∶1∶1∶1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某兴趣小组设计如下微型实验装置。实验时,现断开K2,闭合K1,两极均有气泡产生;一段时间后,断开K1,闭合K2,发现电流表指针偏转,下列有关描述正确的是

A. 断开K2,闭合K1时,总反应的离子方程式为:2H++2Cl—![]() Cl2↑+H2↑
Cl2↑+H2↑
B. 断开K2,闭合K1时,石墨电极附近溶液变红
C. 断开K1,闭合K2时,铜电极上的电极反应为:Cl2+2e—=2Cl—
D. 断开K1,闭合K2时,石墨电极作正极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硼酸(H2BO3)可以通过电解NaB(OH)4溶液的方法制备,工作原理如图所示。下列有关表述错误的是( )
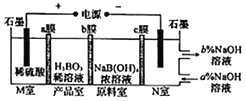
A. M室的电极反应式为2H2O-4e-=O2↑+4H+
B. N室中,进口和出口的溶液浓度大小关系为a%<b%
C. b膜为阴离子交换膜,产品室发生反应为H++[B(OH)4]-=H3BO3+H2O
D. 理论上每生成1molH3BO3,阴极室可生成5.6L气体(标准状况)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】相对分子质量为92的某芳香烃X是一种重要有机化工原料,研究部门以它为初始原料设计出如下转化关系图(部分产物、合成路线、反应条件略去)。其中A是一氯代物,H是一种功能高分子,链节组成为C7H5NO。
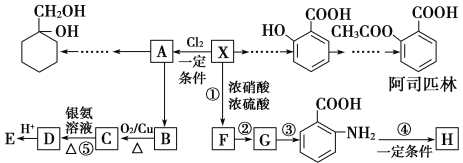
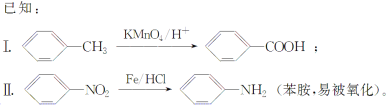
请根据所学知识与本题所给信息回答下列问题:
(1)X的分子中最多有________个原子共面。
(2)H的结构简式为_____________________________________。
(3)反应②、④的类型分别为____________反应、____________反应。
(4)反应⑤的化学方程式是____________________________________________。
(5)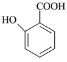 有多种同分异构体,其中含有1个醛基和2个羟基,其核磁共振氢谱图中峰面积之比为1:2:2:1,则符合上述条件的所有同分异构体的结构简式是_______________________。
有多种同分异构体,其中含有1个醛基和2个羟基,其核磁共振氢谱图中峰面积之比为1:2:2:1,则符合上述条件的所有同分异构体的结构简式是_______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种三室微生物燃料电池可用于污水净化、海水淡化,其工作原理如图所示。以下说法不正确的是

A. 中间室Cl—移向左室 B. 处理后的含硝酸根废水pH降低
C. X气体为CO2 D. 电路中每通过1 mol电子,产生标准状况下氮气的体积为2.24L
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com