
【题目】硼酸(H2BO3)可以通过电解NaB(OH)4溶液的方法制备,工作原理如图所示。下列有关表述错误的是( )
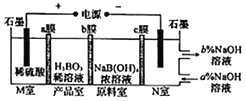
A. M室的电极反应式为2H2O-4e-=O2↑+4H+
B. N室中,进口和出口的溶液浓度大小关系为a%<b%
C. b膜为阴离子交换膜,产品室发生反应为H++[B(OH)4]-=H3BO3+H2O
D. 理论上每生成1molH3BO3,阴极室可生成5.6L气体(标准状况)
【答案】D
【解析】由题意知,通过电解NaB(OH)4溶液的方法制备硼酸(H3BO3),左边为阳极室,右边为阴极室。阳极上OH-放电产生H+,所以a膜为阳离子交换膜、b膜为阴离子交换膜,产品室发生反应为H++[B(OH)4]-=H3BO3+H2O;阴极上H+放电产生OH-,c膜为阳离子交换膜,所以电解后氢氧化钠溶液的浓度变大。A. M室发生的电极反应式为2H2O-4e-=O2↑+4H+,A正确;B. N室中,进口和出口的溶液浓度大小关系为a%<b%,B正确;C. b膜为阴离子交换膜,产品室发生反应为H++[B(OH)4]-=H3BO3+H2O,C正确;D. 理论上每生成1mol产品,电路中转移1mol电子,阴极室可生成0.5molH2,在标准状况下体积为11.2L,D不正确。本题选D。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】在一定温度下的密闭容器中,反应A(g)+B(g)![]() 2C(g)达到平衡状态的标志是
2C(g)达到平衡状态的标志是
A. 混合气体的质量不再发生变化
B. 容器内的总压强不再发生变化
C. 混合气体的平均相对分子质量不再发生变化
D. 单位时间内生成n mol A,同时消耗n mol B
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 将40 g NaOH溶于1L水中,所得NaOH溶液的浓度为1 mol·L-1
B. 将2.3 g Na投入到97.7 g水中充分反应,所得溶液中溶质的质量分数为4.0%
C. 在t℃时,将agNH3完全溶于水,得到VmL溶液。该溶液的物质的量浓度为![]() mol·L-1
mol·L-1
D. 1mol·L-1的硫酸溶液中c(H+)=1mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期主族元素W、X、Y、Z的原子序数依次增大,A、B、C、D、E均由上述元素组成的中学化学常见的物质,其中A是单质,C是酸性氧化物,A的水溶液和C均具有漂白性,B是自然界最常见的液体,E是三元化台物,物质之间存在如右下图所示的关系。下列说法不正确的是

A. YX2遇到蓝色石蕊试液先变红后褪色 B. 离子半径大小关系:Y>Z>X>W
C. 简单阴离子的还原性:Y>Z D. Y与Z属于同一周期,与X属于同一主族
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】煤的主要组成元素是碳、氢、氧、硫、氮,还有极少量的磷、砷、锗、镓、铟等元素, 燃煤产生CxHy、SO2、NOX等大气污染物,研究NO2、NO、CO、SO2等大气污染物和水污染物的处理对建设美丽中国具有重要意义。
(1)锗是第四周期第ⅣA元素,其原子结构示意图为_______________。
(2)利用煤的气化获得的水煤气(主要成分为CO、CO2和H2)在催化剂作用下可以合成绿色燃料甲醇。
已知:H2O(l)=H2O(g) △H1=+44.0kJ/mol
CO2(g)+H2(g)=CO(g)+H2O(l) △H2=-3.0 kJ/mol
CO2(g)+3H2(g)=CH3OH(g)+H2O(g) △H3=-58.7 kJ/mol
写出由CO与H2制备CH3OH气体的热化学方程式_________________。
(3)甲醇和CO2可直接合成碳酸二甲酯(CH3OCOOCH3,简称DMC):
2CH3OH(g)+CO2(g)![]() CH3OCOOCH3(g)+H2O(g) △H4<0
CH3OCOOCH3(g)+H2O(g) △H4<0
①该化学反应的平衡常数表达式为K=________________。
②在恒温恒容密闭容器中发生上述反应,能说明反应达到平衡状态的是_______(填标号)。
A.v正(CH3OH)= 2v逆(H2O) B.容器内气体的密度不变
C.容器内压强不变 D.CH3OH与CO2的物质的量之比保持不变
③一定条件下分别向甲、乙、丙三个恒容密闭容器中加入一定量的初始物质发生该反应,各容器中温度、反应物的起始量如下表,反应过程中DMC的物质的量浓度随时间变化如下图所示:


甲容器中,在5-15min中的平均反应速率v(CO2) =__________。乙容器中,若平衡时n(CO2) =0.2mol,则T1__________T2(填“>”“<"或”=”)。甲、丙两容器的反应达平衡时CO2的转化率:甲__________丙(填“>”“<"或”=”)。
(4)直接排放含SO2的烟气会形成酸雨,危害环境。可用NaOH吸收,所得含硫各微粒(H2SO3、HSO3-和SO32-)存在于反应后的溶液中,它们的物质的量分数X(ⅰ)与溶液pH的关系如图所示。

①若是0.1mol/LNaOH 反应后的溶液,测得溶液的pH=8时,溶液中各离子浓度由大到小的顺序是__________________。
②向pH=5的NaHSO3溶液中滴加一定浓度的CaCl2 溶液,溶液中出现浑浊,pH降为2,用化学平衡移动原理解释溶液pH降低的原因_________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某混合物甲中含有明矾[KAl(SO4)2·12H2O]、Al2O3和Fe2O3。在一定条件下由甲可实现下图所示的物质之间的转化:
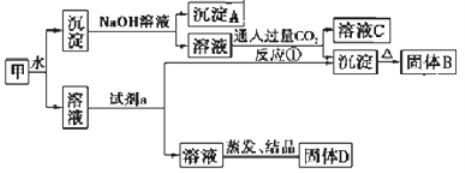
请回答下列问题:
(1)写出A、B的化学式:A__________,B__________。
(2)试剂a最好选用下列试剂中的______________。
A.NaOH溶液 B.稀盐酸 C.二氧化碳 D.氨水
写出相应的离子方程式_____________________________________。
(3)写出反应①(生成溶液C和沉淀)的离子方程式______________。
(4)固体D可以作为复合性的化学肥料,D中所含物质的化学式为_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醇、乙醇是生活中常见且用途广泛的物质,其合成方法和性质均具有研究价值。
(1)已知下表中键能数据,则气态乙醇完全燃烧生成CO2和水蒸气的热化学方程式为__________。
化学键 | C-C | C-H | O-O | H-O | C-O | C-O |
键能/(kJ·mol-1) | 348 | 413 | 498 | 463 | 351 | 799 |
(2)向一容积可变的密闭容器中充入1mol CO与2 molH2,发生反应:CO(g)+2H2(g)![]() CH3OH(g) △H1<0。CO在不同温度下的平衡转化率(a)与压强的关系如图所示。
CH3OH(g) △H1<0。CO在不同温度下的平衡转化率(a)与压强的关系如图所示。
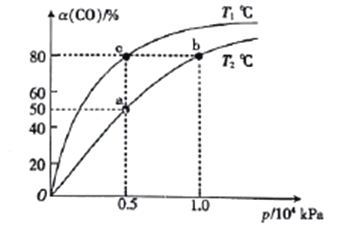
①a、b两点的反位速率:v(b)_____v(a)(填“>”“<”或“=”,下同)。
②T1____T2。
③该合成反应的温度一般控制在240~270℃,选择此范围的原因:此温度范围下的催化剂活性高;__________________________。
④图中a、b、c三点对应的化学平衡常教K(a)、K(b)、K(c)的大小关系为_________。
(3)利用合成气(主要成分为CO和H2)合成甲醇,主要发生如下反应:
CO(g)+2H2(g) ![]() CH3OH(g) △H1;
CH3OH(g) △H1;
CO2(g)+H2(g) ![]() CO(g)+H2O(g) △H2;
CO(g)+H2O(g) △H2;
CO2(g)+3H2(g) ![]() CH3OH(g)+H2O(g) △H3。
CH3OH(g)+H2O(g) △H3。
上述反应对应的平衡常数分别为K1、K2、K3,其中K1、K2随温度的变化如图所示。

则△H1_____((填“>”“<”或“=”) △H3,理由是__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】月球含有H、He、N、Na、Mg、Si等元素,是人类未来的资源宝库。
(1)3He是高效核能原料,其原子核内中子数为_____________。
(2)Na的原子结构示意图为______。
(3)MgCl2在工业上应用广泛,可由MgO制备。
①月球上某矿石经处理得到的MgO中含有少量SiO2,用NaOH溶液除去SiO2的化学方程式为______。
②MgO与炭粉和氯气在一定条件下反应可制备MgCl2,尾气中的氯气可用足量冷的NaOH溶液完全吸收,则生成的盐为_________、_________(写化学式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】pC类似pH,是指极稀溶液中,溶质物质的量浓度的常用对数负值。如某溶液溶质的浓度为1×10-3mol·L-1,则该溶液中溶质的pC=-lg(1×10-3)=3。如图为H2CO3在加入强酸或强碱溶液后,平衡时溶液中三种成分的pC-pH图。下列说法不正确的是

A. H2CO3、HCO3-、CO32-不能在同一溶液中大量共存
B. H2CO3电离平衡常数Ka1≈10-6
C. pH=7时,溶液中存在关系c(HCO![]() )>c(H2CO3)>c(CO
)>c(H2CO3)>c(CO![]() )
)
D. pH=9时,溶液中存在关系c(H+)+c(H2CO3)=c(OH-)+c(CO![]() )
)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com