
【题目】下列说法正确的是
A. 将40 g NaOH溶于1L水中,所得NaOH溶液的浓度为1 mol·L-1
B. 将2.3 g Na投入到97.7 g水中充分反应,所得溶液中溶质的质量分数为4.0%
C. 在t℃时,将agNH3完全溶于水,得到VmL溶液。该溶液的物质的量浓度为![]() mol·L-1
mol·L-1
D. 1mol·L-1的硫酸溶液中c(H+)=1mol·L-1
科目:高中化学 来源: 题型:
【题目】如下图所示,请按要求回答下列问题

(1)打开K1,合并K2.A为___________(填“阴或阳")极,在该电极可观察到的现象是__________;B极的电极反应为______________________;当有0.4mol电子转移时,则析出铜的质量为____ g.
(2)打开K2,合并K1,A为_______(填“正”或“负)极,在该电极可观察到的现象是___________;B极的电极反应为____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在1905年,德国人哈伯发明了工业合成氨技术,其反应方程式是N2(g)+3H2(g)![]() 2NH3(g) △H<0。下图是合成氨反应平衡混合气中NH3的体积分数随温度或压强变化的曲线,图中L(L1、L2)、X分别代表温度或压强。下列说法正确的是
2NH3(g) △H<0。下图是合成氨反应平衡混合气中NH3的体积分数随温度或压强变化的曲线,图中L(L1、L2)、X分别代表温度或压强。下列说法正确的是

A. L代表的是压强,且L1>L2
B. L代表的是压强,且L1<L2
C. L代表的是温度,且L1<L2
D. L代表的是温度,且L1>L2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)在一定条件下:CO(g)+H2O(g)![]() CO2(g)+H2(g),在两个均为2L的密闭容器中以不同的氢碳比[n(H2O)/n(CO)]充入H2O(g)和CO,CO的平衡转化率α(CO)与温度的关系如下图所示。
CO2(g)+H2(g),在两个均为2L的密闭容器中以不同的氢碳比[n(H2O)/n(CO)]充入H2O(g)和CO,CO的平衡转化率α(CO)与温度的关系如下图所示。

①R点平衡常数K=__________________。
②氢碳比X_________2.0(填“>”或“<”或“=”),判断的理由是______________。
③下列能提高CO平衡转化率的措施有_________。
A.使用高效催化剂 B.通入He气体使体系的压强增大
C.降低反应温度 D.投料比不变,增加反应物的浓度
(2)已知:反应I:4NH3(g)+5O2(g)![]() 4NO(g)+6H2O(g) △H<0
4NO(g)+6H2O(g) △H<0
反应II:4NH3(g)+3O2(g)![]() 2N2(g)+6H2O(g) △H<0
2N2(g)+6H2O(g) △H<0
氨催化氧化时会发生上述两个竞争反应I和Ⅱ。为分析该催化剂对该反应的选择性,在1L密闭容器中充入1molNH3和2molO2,反应关系如图,该催化剂在高温时选择反应_________(填“I”或“II”)。520℃时,4NH3(g)+3O2(g)![]() 2N2(g)+6H2O(g)的平衡常数K=_______(只需列出数字计算式)。
2N2(g)+6H2O(g)的平衡常数K=_______(只需列出数字计算式)。

(3)以连二硫酸根(S2O42-)为介质,使用间接电化学法可处理燃煤烟气中的NO,装置如图所示:

①阴极区的电极反应式为___________。
②NO吸收转化后的主要产物为NH4+,若通电时电路中转移了0.3mol e-,则此通电过程中理论上吸收的NO在标准状况下的体积为___________mL。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸是当今世界最重要的化工产品之一。
I.硫酸的各种制法。
(1)早在1000多年前,我国就已采用加热胆矾(CuSO4· 5H2O)或绿矾(FeSO4·7H2O)的方法制取硫酸。FeSO4受热分解的化学方程式:2 FeSO4![]() Fe2O3+SO2↑ +SO3↑。
Fe2O3+SO2↑ +SO3↑。
① 将FeSO4受热产生的气体通入如下图装置中,以检验产生的气体中是否含有SO3和SO2。 能说明SO2存在的实验现象是_________。

② 有同学提出虚线框内盛装NaOH溶液的装置可以换成上图右边的a装置,其中多孔玻璃球泡的作用是__________。
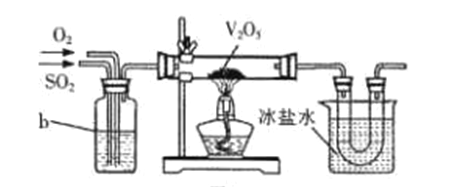
(2)目前工业上主要采用接触法制备硫酸,其中一步为:2SO2+O2![]() 2SO3。实验室模拟该过程常用下图装置进行实验。b装置中装有浓硫酸,写出b装置的作用__________(写出两点)。
2SO3。实验室模拟该过程常用下图装置进行实验。b装置中装有浓硫酸,写出b装置的作用__________(写出两点)。
Ⅱ.硫酸的性质。
(3)下图中甲试管内发生反应的化学方程式_________ ,该反应体现了浓硫酸的性质为______。
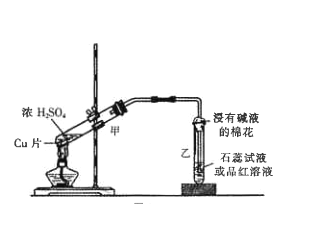
(4)当铜片与浓硫酸充分反应后,试管内并未出现蓝色溶液,而是看到白色固体,请写出检验白色固体的方法______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】把一块镁铝合金投入到1mol/L盐酸中,待合金完全溶解后(盐酸有剩余),再往溶液里加入1mol/LNaOH溶液,生成沉淀的物质的量随加入NaOH溶液体积的变化如图所示。下列说法中错误的是( )
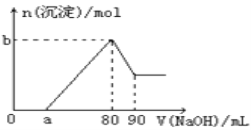
A. 盐酸的体积为80mL
B. a的取值范围为0<a<50
C. 当a值为30时,b值为0.01
D. n(Mg2+)<0.025mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验现象描述错误的是
编号 | 实验 | 现象 |
A | 加热放在坩埚中的小块钠 | 钠先熔化成光亮的小球,燃烧时,火焰为黄色,燃烧后,生成淡黄色固体 |
B | 在酒精灯上加热用砂纸打磨过的铝箔 | 铝箔变软,失去光泽,熔化的铝并不滴落 |
C | 在FeCl2溶液中滴入NaOH溶液 | 生成白色沉淀,沉淀很快变为灰绿色,最后变为红褐色 |
D | 将水蒸气通过灼热的铁粉 | 黑色粉末变为红褐色 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硼酸(H2BO3)可以通过电解NaB(OH)4溶液的方法制备,工作原理如图所示。下列有关表述错误的是( )
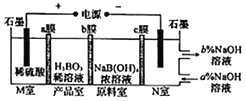
A. M室的电极反应式为2H2O-4e-=O2↑+4H+
B. N室中,进口和出口的溶液浓度大小关系为a%<b%
C. b膜为阴离子交换膜,产品室发生反应为H++[B(OH)4]-=H3BO3+H2O
D. 理论上每生成1molH3BO3,阴极室可生成5.6L气体(标准状况)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表中实验操作、现象与结论对应关系正确的是
选项 | 实验操作 | 实验现象 | 结论 |
A | 以酚酞为指示剂,用盐酸标准液滴定氢氧化钠溶液 | 溶液由红色变为浅红色便立刻读数 | 测得氢氧化钠溶液的浓度偏大 |
B | 向含有酚酞的Na2CO3溶液中加入少量BaC12固体 | 有白色沉淀生成,溶液红色变浅 | 证明纯碱溶液呈碱性是由CO32-水解引起的 |
C | 室温下分别测定NaClO溶液、CH3COONa溶液的pH | 前者大 | 酸性:HClO>CH3COOH |
D | NaHCO3溶液中滴入酚酞 | 溶液变红 | 弱酸的酸式盐溶液均呈碱性 |
A. A B. B C. C D. D
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com