
【题目】在1905年,德国人哈伯发明了工业合成氨技术,其反应方程式是N2(g)+3H2(g)![]() 2NH3(g) △H<0。下图是合成氨反应平衡混合气中NH3的体积分数随温度或压强变化的曲线,图中L(L1、L2)、X分别代表温度或压强。下列说法正确的是
2NH3(g) △H<0。下图是合成氨反应平衡混合气中NH3的体积分数随温度或压强变化的曲线,图中L(L1、L2)、X分别代表温度或压强。下列说法正确的是

A. L代表的是压强,且L1>L2
B. L代表的是压强,且L1<L2
C. L代表的是温度,且L1<L2
D. L代表的是温度,且L1>L2
 优翼小帮手同步口算系列答案
优翼小帮手同步口算系列答案科目:高中化学 来源: 题型:
【题目】写出下列反应的化学方程式:
(1)乙烯和水反应:_________________________________________________
(2)乙醇的催化氧化反应:___________________________________________
(3)溴乙烷的消去反应:_____________________________________________
(4)![]() 与足量的NaOH溶液反应:__________________________________
与足量的NaOH溶液反应:__________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上从含镍电镀废渣(除含镍外,还含有Cu、Zn、Fe等杂质)中制备NiCO3的工艺流程如下。
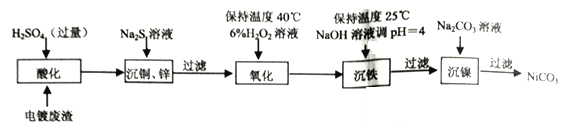
(1)“酸化”时需将电镀废渣粉碎并适当加热,原因是________________________。
(2)“氧化”时需要控制温度不超过40℃,其目的是________________________;“沉铁”后所得滤液中c(Fe3+)=____________mol·L-1[该温度下 Fe(OH))3的Ksp=2.64×10-39]。
(3)Fe2+也可以用NaCO3氧化,一定条件下可生成黄铁矾钠[Na2Fe6(SO4) 4(OH)12沉淀而被除去;如图是pH-温度关系图,图中阴影部分为黄铁矾钠稳定存在区域。

①FeOOH中铁的化合价是____________价。.
②酸性条件下,ClO3ˉ恰好氧化Fe2+时,氧化剂与还原剂物质的量之比是____________。
③根据上图,当T=120℃、pH=4时Fe元素的存在形式是____________(填化学式),该温度下,若要制得黄铁矾钠需控制pH范围____________(填字母选项)。
a.0~1 b.1~2.5 c.2.5~4
(4)已知SOCl2能与水反应生成SO2和HCl。写出NiCl2·6H2O在亚硫酰氯(SOCl2)中加热脱水制无水NCl2的化学方程式____________________________________。NCl2·6H2O需在亚硫酰氯(SOCl2)中加热脱水的原因是________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下的密闭容器中,反应A(g)+B(g)![]() 2C(g)达到平衡状态的标志是
2C(g)达到平衡状态的标志是
A. 混合气体的质量不再发生变化
B. 容器内的总压强不再发生变化
C. 混合气体的平均相对分子质量不再发生变化
D. 单位时间内生成n mol A,同时消耗n mol B
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 硫离子的结构示意图:![]()
B. 23Na、24Mg两种核素的中子数相等,因此互为同位素
C. CH3COOH的电离方程式为:CH3COOH![]() CH3COO-+H+
CH3COO-+H+
D. 16O、1H、2H、3H四种核素可构成4种水分子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知水中存在电离平衡:H2O![]() H++OH-。下列说法正确的是
H++OH-。下列说法正确的是
A. 升高温度,Kw增大,pH不变
B. 向水中加入氨水,平衡向逆反应方向移动,c(OH-)降低
C. 向水中通入CO2,c(H+)增大,平衡向逆反应方向移动,Kw不变
D. 向水中加入少量固体CH3COONa,平衡向逆反应方向移动,c(H+)降低
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C均为中学化学常见的纯净物,它们之间存在如下转化关系:
![]()
其中①②③均为有单质参与的反应。
(1)若A是常见的金属,①③中均有同一种气态非金属单质参与反应,B溶液遇KSCN显血红色,且②为化合反应,写出反应②的离子方程式_______________________________。
(2)如何检验上述C溶液中的阳离子?______________________。
(3)若B是太阳能电池用的光伏材料,①②③为工业制备B的反应。C的化学式是____________,写出反应①的化学方程式____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 将40 g NaOH溶于1L水中,所得NaOH溶液的浓度为1 mol·L-1
B. 将2.3 g Na投入到97.7 g水中充分反应,所得溶液中溶质的质量分数为4.0%
C. 在t℃时,将agNH3完全溶于水,得到VmL溶液。该溶液的物质的量浓度为![]() mol·L-1
mol·L-1
D. 1mol·L-1的硫酸溶液中c(H+)=1mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醇、乙醇是生活中常见且用途广泛的物质,其合成方法和性质均具有研究价值。
(1)已知下表中键能数据,则气态乙醇完全燃烧生成CO2和水蒸气的热化学方程式为__________。
化学键 | C-C | C-H | O-O | H-O | C-O | C-O |
键能/(kJ·mol-1) | 348 | 413 | 498 | 463 | 351 | 799 |
(2)向一容积可变的密闭容器中充入1mol CO与2 molH2,发生反应:CO(g)+2H2(g)![]() CH3OH(g) △H1<0。CO在不同温度下的平衡转化率(a)与压强的关系如图所示。
CH3OH(g) △H1<0。CO在不同温度下的平衡转化率(a)与压强的关系如图所示。
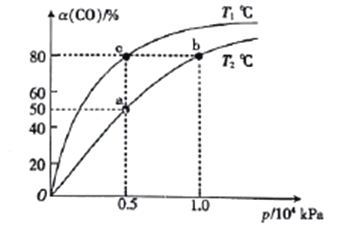
①a、b两点的反位速率:v(b)_____v(a)(填“>”“<”或“=”,下同)。
②T1____T2。
③该合成反应的温度一般控制在240~270℃,选择此范围的原因:此温度范围下的催化剂活性高;__________________________。
④图中a、b、c三点对应的化学平衡常教K(a)、K(b)、K(c)的大小关系为_________。
(3)利用合成气(主要成分为CO和H2)合成甲醇,主要发生如下反应:
CO(g)+2H2(g) ![]() CH3OH(g) △H1;
CH3OH(g) △H1;
CO2(g)+H2(g) ![]() CO(g)+H2O(g) △H2;
CO(g)+H2O(g) △H2;
CO2(g)+3H2(g) ![]() CH3OH(g)+H2O(g) △H3。
CH3OH(g)+H2O(g) △H3。
上述反应对应的平衡常数分别为K1、K2、K3,其中K1、K2随温度的变化如图所示。

则△H1_____((填“>”“<”或“=”) △H3,理由是__________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com