
【题目】在一定温度下的密闭容器中,反应A(g)+B(g)![]() 2C(g)达到平衡状态的标志是
2C(g)达到平衡状态的标志是
A. 混合气体的质量不再发生变化
B. 容器内的总压强不再发生变化
C. 混合气体的平均相对分子质量不再发生变化
D. 单位时间内生成n mol A,同时消耗n mol B
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】下列反应是氧化还原反应的是( )
A. CaCO3![]() CaO+CO2↑
CaO+CO2↑
B. CH4+2O2![]() 2H2O+CO2
2H2O+CO2
C. Na2CO3+2HCl=2NaCl+H2O+CO2↑
D. 2NaOH+H2SO4=Na2SO4+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如下图所示,请按要求回答下列问题

(1)打开K1,合并K2.A为___________(填“阴或阳")极,在该电极可观察到的现象是__________;B极的电极反应为______________________;当有0.4mol电子转移时,则析出铜的质量为____ g.
(2)打开K2,合并K1,A为_______(填“正”或“负)极,在该电极可观察到的现象是___________;B极的电极反应为____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有浓度均为0.1mol/L的MgCl2溶液、氨水溶液,按体积比1:2混合。已知Mg(OH)2的Ksp=4.0×10—12,下列说法正确的是
A、混合前,氨水溶液中c(NH4+):c(OH—)=1:1
B、混合后c(NH4+):c(Cl—)=1:1
C、混合后c(Mg2+)×c(OH—)= 4.0×10—12
D、向混合后的分散系中加入FeCl3溶液,白色沉淀变红褐色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】①~⑨是几种有机物的名称或化学式:
①2,2,3﹣三甲基丁烷、②3﹣甲基﹣1﹣氯戊烷、③甲苯、④![]() 、 ⑤ClCH=CHCl、⑥
、 ⑤ClCH=CHCl、⑥![]() ⑦
⑦ ⑧
⑧ ⑨1,3,5﹣庚三烯
⑨1,3,5﹣庚三烯
据此回答下列问题:
(1)上述有机物中,互为同分异构体的是______(用编号表示),存在顺反异构的是______(用编号表示).
(2)以③有机物为原料制备TNT炸药的化学方程式为______.
(3)已知在有机物分子中,若某个碳原子上连接4个不同的原子或基团,则这种碳原子称为“手性碳原子”,如 中带*的C原子。[若同一个碳原子上连着2个碳碳双键(如C═C═C)时,分子极不稳定,不存在。]⑨1,3,5﹣庚三烯的众多链烃同分异构体中:含有“手性碳原子”,且与足量H2发生加成反应后仍具有“手性碳原子”的______种.含有“手性碳原子”,但与足量H2发生加成反应后,不具有“手性碳原子”的结构简式是____.
中带*的C原子。[若同一个碳原子上连着2个碳碳双键(如C═C═C)时,分子极不稳定,不存在。]⑨1,3,5﹣庚三烯的众多链烃同分异构体中:含有“手性碳原子”,且与足量H2发生加成反应后仍具有“手性碳原子”的______种.含有“手性碳原子”,但与足量H2发生加成反应后,不具有“手性碳原子”的结构简式是____.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于有机物的说法正确的是
A. 杜康用高粱酿酒的原理是通过蒸馏法将高粱中的乙醇分离出来。
B. 聚合物![]() 可由单体CH3CH=CH2和CH2=CH2加聚制得。
可由单体CH3CH=CH2和CH2=CH2加聚制得。
C. 相对分子质量为72的某烷烃,一氯代物有4种。
D. 植物油氢化、塑料和橡胶的老化过程中均发生了加成反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在1905年,德国人哈伯发明了工业合成氨技术,其反应方程式是N2(g)+3H2(g)![]() 2NH3(g) △H<0。下图是合成氨反应平衡混合气中NH3的体积分数随温度或压强变化的曲线,图中L(L1、L2)、X分别代表温度或压强。下列说法正确的是
2NH3(g) △H<0。下图是合成氨反应平衡混合气中NH3的体积分数随温度或压强变化的曲线,图中L(L1、L2)、X分别代表温度或压强。下列说法正确的是

A. L代表的是压强,且L1>L2
B. L代表的是压强,且L1<L2
C. L代表的是温度,且L1<L2
D. L代表的是温度,且L1>L2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)在一定条件下:CO(g)+H2O(g)![]() CO2(g)+H2(g),在两个均为2L的密闭容器中以不同的氢碳比[n(H2O)/n(CO)]充入H2O(g)和CO,CO的平衡转化率α(CO)与温度的关系如下图所示。
CO2(g)+H2(g),在两个均为2L的密闭容器中以不同的氢碳比[n(H2O)/n(CO)]充入H2O(g)和CO,CO的平衡转化率α(CO)与温度的关系如下图所示。

①R点平衡常数K=__________________。
②氢碳比X_________2.0(填“>”或“<”或“=”),判断的理由是______________。
③下列能提高CO平衡转化率的措施有_________。
A.使用高效催化剂 B.通入He气体使体系的压强增大
C.降低反应温度 D.投料比不变,增加反应物的浓度
(2)已知:反应I:4NH3(g)+5O2(g)![]() 4NO(g)+6H2O(g) △H<0
4NO(g)+6H2O(g) △H<0
反应II:4NH3(g)+3O2(g)![]() 2N2(g)+6H2O(g) △H<0
2N2(g)+6H2O(g) △H<0
氨催化氧化时会发生上述两个竞争反应I和Ⅱ。为分析该催化剂对该反应的选择性,在1L密闭容器中充入1molNH3和2molO2,反应关系如图,该催化剂在高温时选择反应_________(填“I”或“II”)。520℃时,4NH3(g)+3O2(g)![]() 2N2(g)+6H2O(g)的平衡常数K=_______(只需列出数字计算式)。
2N2(g)+6H2O(g)的平衡常数K=_______(只需列出数字计算式)。

(3)以连二硫酸根(S2O42-)为介质,使用间接电化学法可处理燃煤烟气中的NO,装置如图所示:

①阴极区的电极反应式为___________。
②NO吸收转化后的主要产物为NH4+,若通电时电路中转移了0.3mol e-,则此通电过程中理论上吸收的NO在标准状况下的体积为___________mL。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硼酸(H2BO3)可以通过电解NaB(OH)4溶液的方法制备,工作原理如图所示。下列有关表述错误的是( )
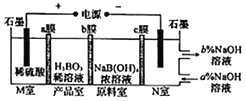
A. M室的电极反应式为2H2O-4e-=O2↑+4H+
B. N室中,进口和出口的溶液浓度大小关系为a%<b%
C. b膜为阴离子交换膜,产品室发生反应为H++[B(OH)4]-=H3BO3+H2O
D. 理论上每生成1molH3BO3,阴极室可生成5.6L气体(标准状况)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com