
【题目】如下图所示,请按要求回答下列问题

(1)打开K1,合并K2.A为___________(填“阴或阳")极,在该电极可观察到的现象是__________;B极的电极反应为______________________;当有0.4mol电子转移时,则析出铜的质量为____ g.
(2)打开K2,合并K1,A为_______(填“正”或“负)极,在该电极可观察到的现象是___________;B极的电极反应为____________________。
【答案】 阴 A上有红色金属析出 Cu﹣2e﹣=Cu2+ 12.8 负 A处金属不断溶解 Cu2++2e﹣=Cu
【解析】试题分析:(1)打开K1,合并K2,构成电解池,A与电源的负极相连,B与正极相连;根据阴极电极反应式计算0.4mol电子转移时析出铜的质量;(2)打开K2,合并K1,构成原电池,锌的活泼性大于铜,所以锌是负极、铜是正极;
解析:(1)打开K1,合并K2,构成电解池,A与电源的负极相连,A是阴极,A极电极反应式是![]() ,所以现象是A上有红色金属析出;B与正极相连,B是阳极,阳极电极反应式是Cu﹣2e﹣=Cu2+;根据
,所以现象是A上有红色金属析出;B与正极相连,B是阳极,阳极电极反应式是Cu﹣2e﹣=Cu2+;根据![]() ,有 0.4mol电子转移时,生成铜的物质的量是0.2mol,质量是12.8;(2)打开K2,合并K1,构成原电池,锌的活泼性大于铜,锌是负极、铜是正极;所以A为负极,电极反应式是
,有 0.4mol电子转移时,生成铜的物质的量是0.2mol,质量是12.8;(2)打开K2,合并K1,构成原电池,锌的活泼性大于铜,锌是负极、铜是正极;所以A为负极,电极反应式是![]() ,现象是A处金属不断溶解;B极是正极,电极反应为Cu2++2e﹣=Cu。
,现象是A处金属不断溶解;B极是正极,电极反应为Cu2++2e﹣=Cu。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】(1)同温同压下,同体积的甲烷(CH4)和二氧化碳分子数之比为_____,物质的量之比为_____,质量之比为_____。
(2)等质量的 SO2 和 SO3 物质的量之比是_____,氧原子数之比为_____。
(3)19 g 某二价金属的氯化物 ACl2 中含有 0.4mol Cl-,则 A 的摩尔质量为_____。
(4)密度为 1.84 g/cm3,质量分数为 98%的浓硫酸浓度为_____mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】写出下列反应的化学方程式:
(1)乙烯和水反应:_________________________________________________
(2)乙醇的催化氧化反应:___________________________________________
(3)溴乙烷的消去反应:_____________________________________________
(4)![]() 与足量的NaOH溶液反应:__________________________________
与足量的NaOH溶液反应:__________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在15mL0.lmol·L-1KOH溶液中逐滴加入0.2mol·L-1甲酸溶液,溶液pH和加入甲酸(弱酸)的体积关系曲线如图所示,下列关系正确的是( )

A. 在B点:c(K+)=c(HCOO-)>c(OH-)=c(H+),且a=7.5
B. 在A、B间任意一点,c(HCOO-)>c(K+)>c(OH-)>c(H+)
C. 在D点:c(HCOO-)+c(HCOOH)>2c(K+)
D. B→C段:水的电离程度先增大后减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.4.1gH3PO3可与2gNaOH完全反应生成正盐,则H3PO3为__________元酸。该正盐的电离方程式为_________________。
Ⅱ、小苏打、胃舒平、达喜都是常用的中和胃酸的药物。
(1)小苏打片每片含0.504gNaHCO3,2片小苏打片能中和胃酸中的H+是_____mol。
(2)胃舒平每片含0.234gAl(OH)3,中和胃酸时,6片小苏打片相当于胃舒平__________。
(3)达喜的化学成分是铝和镁的碱式碳酸盐。取该碱式盐粉末3.01g,逐滴加入2.0mol/L盐酸使其溶解(其他成分不与盐酸反应),当加入盐酸42.5mL时,开始产生CO2,加入盐酸至45.0mL时怡好反应完全,则该碱式盐样品中氢氧根与碳酸根的物质的量之比为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲~庚等元素在周期表中的相对位置如下表,己的最高氧化物对应水化物有强脱水性,甲和丁在同一周期,甲原子最外层与最内层具有相同电子数。下列判断正确的是
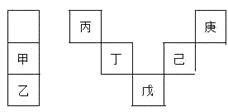
A. 丙与戊的原子序数相差28
B. 气态氢化物的稳定性:庚<己<戊
C. 常温下,甲和乙的单质均能与水剧烈反应
D. 丁的最高价氧化物可用于制造光导纤维
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上从含镍电镀废渣(除含镍外,还含有Cu、Zn、Fe等杂质)中制备NiCO3的工艺流程如下。
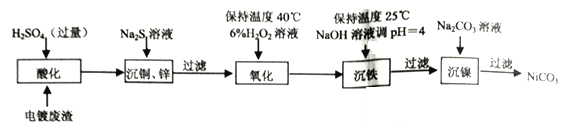
(1)“酸化”时需将电镀废渣粉碎并适当加热,原因是________________________。
(2)“氧化”时需要控制温度不超过40℃,其目的是________________________;“沉铁”后所得滤液中c(Fe3+)=____________mol·L-1[该温度下 Fe(OH))3的Ksp=2.64×10-39]。
(3)Fe2+也可以用NaCO3氧化,一定条件下可生成黄铁矾钠[Na2Fe6(SO4) 4(OH)12沉淀而被除去;如图是pH-温度关系图,图中阴影部分为黄铁矾钠稳定存在区域。

①FeOOH中铁的化合价是____________价。.
②酸性条件下,ClO3ˉ恰好氧化Fe2+时,氧化剂与还原剂物质的量之比是____________。
③根据上图,当T=120℃、pH=4时Fe元素的存在形式是____________(填化学式),该温度下,若要制得黄铁矾钠需控制pH范围____________(填字母选项)。
a.0~1 b.1~2.5 c.2.5~4
(4)已知SOCl2能与水反应生成SO2和HCl。写出NiCl2·6H2O在亚硫酰氯(SOCl2)中加热脱水制无水NCl2的化学方程式____________________________________。NCl2·6H2O需在亚硫酰氯(SOCl2)中加热脱水的原因是________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下的密闭容器中,反应A(g)+B(g)![]() 2C(g)达到平衡状态的标志是
2C(g)达到平衡状态的标志是
A. 混合气体的质量不再发生变化
B. 容器内的总压强不再发生变化
C. 混合气体的平均相对分子质量不再发生变化
D. 单位时间内生成n mol A,同时消耗n mol B
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 将40 g NaOH溶于1L水中,所得NaOH溶液的浓度为1 mol·L-1
B. 将2.3 g Na投入到97.7 g水中充分反应,所得溶液中溶质的质量分数为4.0%
C. 在t℃时,将agNH3完全溶于水,得到VmL溶液。该溶液的物质的量浓度为![]() mol·L-1
mol·L-1
D. 1mol·L-1的硫酸溶液中c(H+)=1mol·L-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com