
【题目】已知水中存在电离平衡:H2O![]() H++OH-。下列说法正确的是
H++OH-。下列说法正确的是
A. 升高温度,Kw增大,pH不变
B. 向水中加入氨水,平衡向逆反应方向移动,c(OH-)降低
C. 向水中通入CO2,c(H+)增大,平衡向逆反应方向移动,Kw不变
D. 向水中加入少量固体CH3COONa,平衡向逆反应方向移动,c(H+)降低
 启东小题作业本系列答案
启东小题作业本系列答案科目:高中化学 来源: 题型:
【题目】某研究小组利用BaS的还原性提纯HBr溶液,并制取溴化镁的方案如下:

(1) “还原”步骤中BaS不宜过量太多的原因是______。
(2)滤渣的成分是______。
(3)结晶获得的MgBr2·6H2O用乙醇洗涤,从洗涤液中回收乙醇的实验方法是______。
(4)利用如图装置将MgBr2·6H2O脱水得到MgBr2。

①通入HBr的目的是______。
②图中框内装置的作用是______。
(5)已知:BaS+H2O2=Ba(OH)2+S↓。请补充完整实验室由BaS制取高纯BaSO3的实验方案:取BaS加水浸出,边搅拌边在浸出液中加入过量H2O2,过滤,______,(实验中须使用的试剂有:SO2气体,溶有SO2的水,除常用仪器外须使用的仪器有:真空干燥箱、pH计)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有浓度均为0.1mol/L的MgCl2溶液、氨水溶液,按体积比1:2混合。已知Mg(OH)2的Ksp=4.0×10—12,下列说法正确的是
A、混合前,氨水溶液中c(NH4+):c(OH—)=1:1
B、混合后c(NH4+):c(Cl—)=1:1
C、混合后c(Mg2+)×c(OH—)= 4.0×10—12
D、向混合后的分散系中加入FeCl3溶液,白色沉淀变红褐色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于有机物的说法正确的是
A. 杜康用高粱酿酒的原理是通过蒸馏法将高粱中的乙醇分离出来。
B. 聚合物![]() 可由单体CH3CH=CH2和CH2=CH2加聚制得。
可由单体CH3CH=CH2和CH2=CH2加聚制得。
C. 相对分子质量为72的某烷烃,一氯代物有4种。
D. 植物油氢化、塑料和橡胶的老化过程中均发生了加成反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在1905年,德国人哈伯发明了工业合成氨技术,其反应方程式是N2(g)+3H2(g)![]() 2NH3(g) △H<0。下图是合成氨反应平衡混合气中NH3的体积分数随温度或压强变化的曲线,图中L(L1、L2)、X分别代表温度或压强。下列说法正确的是
2NH3(g) △H<0。下图是合成氨反应平衡混合气中NH3的体积分数随温度或压强变化的曲线,图中L(L1、L2)、X分别代表温度或压强。下列说法正确的是

A. L代表的是压强,且L1>L2
B. L代表的是压强,且L1<L2
C. L代表的是温度,且L1<L2
D. L代表的是温度,且L1>L2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,将1.000 mol/L盐酸滴入20.00 mL 1.000 mol/L氨水中,溶液pH和温度随加入盐酸体积变化曲线如图所示。下列有关说法正确的是

A. d点后,溶液温度略下降的主要原因是NH3·H2O电离吸热
B. a点由水电离出的c(H+)=1.0![]() mol/L
mol/L
C. b点:c(NH![]() )+c(NH3·H2O)=c(Cl-)
)+c(NH3·H2O)=c(Cl-)
D. c点:c(Cl-)=c(NH![]() )
)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)在一定条件下:CO(g)+H2O(g)![]() CO2(g)+H2(g),在两个均为2L的密闭容器中以不同的氢碳比[n(H2O)/n(CO)]充入H2O(g)和CO,CO的平衡转化率α(CO)与温度的关系如下图所示。
CO2(g)+H2(g),在两个均为2L的密闭容器中以不同的氢碳比[n(H2O)/n(CO)]充入H2O(g)和CO,CO的平衡转化率α(CO)与温度的关系如下图所示。

①R点平衡常数K=__________________。
②氢碳比X_________2.0(填“>”或“<”或“=”),判断的理由是______________。
③下列能提高CO平衡转化率的措施有_________。
A.使用高效催化剂 B.通入He气体使体系的压强增大
C.降低反应温度 D.投料比不变,增加反应物的浓度
(2)已知:反应I:4NH3(g)+5O2(g)![]() 4NO(g)+6H2O(g) △H<0
4NO(g)+6H2O(g) △H<0
反应II:4NH3(g)+3O2(g)![]() 2N2(g)+6H2O(g) △H<0
2N2(g)+6H2O(g) △H<0
氨催化氧化时会发生上述两个竞争反应I和Ⅱ。为分析该催化剂对该反应的选择性,在1L密闭容器中充入1molNH3和2molO2,反应关系如图,该催化剂在高温时选择反应_________(填“I”或“II”)。520℃时,4NH3(g)+3O2(g)![]() 2N2(g)+6H2O(g)的平衡常数K=_______(只需列出数字计算式)。
2N2(g)+6H2O(g)的平衡常数K=_______(只需列出数字计算式)。

(3)以连二硫酸根(S2O42-)为介质,使用间接电化学法可处理燃煤烟气中的NO,装置如图所示:

①阴极区的电极反应式为___________。
②NO吸收转化后的主要产物为NH4+,若通电时电路中转移了0.3mol e-,则此通电过程中理论上吸收的NO在标准状况下的体积为___________mL。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】把一块镁铝合金投入到1mol/L盐酸中,待合金完全溶解后(盐酸有剩余),再往溶液里加入1mol/LNaOH溶液,生成沉淀的物质的量随加入NaOH溶液体积的变化如图所示。下列说法中错误的是( )
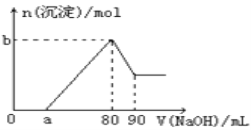
A. 盐酸的体积为80mL
B. a的取值范围为0<a<50
C. 当a值为30时,b值为0.01
D. n(Mg2+)<0.025mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是( )
A. H2分子中含σ键而N2分子中还含π键
B. π键是由两个p轨道“肩并肩”重叠形成的
C. 乙烷分子中的键全为σ键而乙烯分子中含σ键和π键
D. σ键一定是有s轨道参与形成的
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com