
����Ŀ��ú����Ҫ���Ԫ����̼���⡢�����������м��������ס��顢�ࡢ�ء�����Ԫ�أ� ȼú����CxHy��SO2��NOX�ȴ�����Ⱦ��о�NO2��NO��CO��SO2�ȴ�����Ⱦ���ˮ��Ⱦ��Ĵ����Խ��������й�������Ҫ���塣
(1)���ǵ������ڵڢ�AԪ�أ���ԭ�ӽṹʾ��ͼΪ_______________��
(2)����ú��������õ�ˮú��(��Ҫ�ɷ�ΪCO��CO2��H2)�ڴ��������¿��Ժϳ���ɫȼ�ϼ״���
��֪��H2O(l)=H2O(g) ��H1=+44.0kJ/mol
CO2(g)+H2(g)=CO(g)+H2O(l) ��H2=-3.0 kJ/mol
CO2(g)+3H2(g)=CH3OH(g)+H2O(g) ��H3=-58.7 kJ/mol
д����CO��H2�Ʊ�CH3OH������Ȼ�ѧ����ʽ_________________��
(3)�״���CO2��ֱ�Ӻϳ�̼�������(CH3OCOOCH3�����DMC)��
2CH3OH(g)+CO2(g)![]() CH3OCOOCH3(g)+H2O(g) ��H4<0
CH3OCOOCH3(g)+H2O(g) ��H4<0
�ٸû�ѧ��Ӧ��ƽ�ⳣ������ʽΪK=________________��
���ں��º����ܱ������з���������Ӧ����˵����Ӧ�ﵽƽ��״̬����_______(����)��
A��v��(CH3OH)= 2v��(H2O) B��������������ܶȲ���
C��������ѹǿ���� D��CH3OH��CO2�����ʵ���֮�ȱ��ֲ���
��һ�������·ֱ���ס��ҡ������������ܱ������м���һ�����ij�ʼ���ʷ����÷�Ӧ�����������¶ȡ���Ӧ�����ʼ�����±�����Ӧ������DMC�����ʵ���Ũ����ʱ��仯����ͼ��ʾ��


�������У���5-15min�е�ƽ����Ӧ����v(CO2) =__________���������У���ƽ��ʱn(CO2) =0.2mol����T1__________T2(�>����<"��=��)���ס����������ķ�Ӧ��ƽ��ʱCO2��ת���ʣ���__________��(�>����<"��=��)��
(4)ֱ���ŷź�SO2���������γ����꣬Σ������������NaOH���գ����ú������(H2SO3��HSO3-��SO32-)�����ڷ�Ӧ�����Һ�У����ǵ����ʵ�������X(��)����ҺpH�Ĺ�ϵ��ͼ��ʾ��

������0.1mol/LNaOH ��Ӧ�����Һ�������Һ��pH=8ʱ����Һ�и�����Ũ���ɴ�С��˳����__________________��
����pH=5��NaHSO3��Һ�еμ�һ��Ũ�ȵ�CaCl2 ��Һ����Һ�г��ֻ��ǣ�pH��Ϊ2���û�ѧƽ���ƶ�ԭ��������ҺpH���͵�ԭ��_________________________________��
���𰸡� 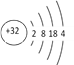 CO(g)+2H2(g)=CH3OH(g) ��H=-99.7kJ��mol-1
CO(g)+2H2(g)=CH3OH(g) ��H=-99.7kJ��mol-1 ![]() AC 0.05mol��L-1��min-1 �� �� c(Na+)��c(SO32-)��c(HSO3-)��c(OH-)��c(H+) ��ΪHSO3-����Һ�м��ܵ��룬����ˮ�⣬�������м����Ȼ���ʱ��������ӦCa2++SO32-=CaSO3����ʹ�����ƽ��HSO3-
AC 0.05mol��L-1��min-1 �� �� c(Na+)��c(SO32-)��c(HSO3-)��c(OH-)��c(H+) ��ΪHSO3-����Һ�м��ܵ��룬����ˮ�⣬�������м����Ȼ���ʱ��������ӦCa2++SO32-=CaSO3����ʹ�����ƽ��HSO3-![]() H++SO32-��c(SO32-)��С�������ƶ�������c(H+)����pH��С
H++SO32-��c(SO32-)��С�������ƶ�������c(H+)����pH��С
��������(1)����Ԫ�ص�ԭ�Ӻ�������Ų�����һ��ĵ����Ų����ɼ��ɻ�����ԭ�ӽṹʾ��ͼ��(2)Ӧ�ø�˹���ɽ����(3)��ѧƽ��״̬���ж������������оݺ��������о���������ȷ���⣬����������Բ���Ӧ��䣬�ǽ���Ĺؼ������ñ����ͼ����Ϣ�����ݷ�Ӧ����ʽ���С�����ʽ��������Ӧ�õ�Чƽ������������Է�Ӧ���ʺͻ�ѧƽ���Ӱ��Ƚ����ۺϷ������ڢۣ��ر��Ǽס��������������ʵĿ����Ͳ���Ũ�ȵĴ�С��Ӱ���������ѵ㣻(4)����ͼ����Ϣ������Һ��pH���ɵ�����Ũ�ȵĴ�С��ϵ�����ֽⷴӦ�ķ����ǵ�����Һ���Ա仯��ԭ����
(1)���ǵ������ڵڢ�AԪ����ԭ������Ϊ32����ԭ�ӽṹʾ��ͼΪ ��
��
(2)���ݸ�˹���ɣ���Ӧ3-��Ӧ2-��Ӧ1�����Ȼ�ѧ����ʽCO(g)+2H2(g)= CH3OH(g) ��H=��H3-��H2-��H1= -99.7kJ��mol-1��
(3)����2CH3OH(g)+CO2(g)![]() CH3OCOOCH3(g)+H2O(g) ��H4<0��
CH3OCOOCH3(g)+H2O(g) ��H4<0��
����ƽ�ⳣ������ʽΪK=![]() ��
��
�ڸ���ƽ��״̬���ж����ݣ�A����v��(CH3OH)= 2v��(H2O)ʱ����Ӧ�Ѵ�ƽ�⣻B����������������䣬���������غ㣬���������ܶ�ʼ�ն����䣬�������������ܶȲ���ʱ����˵����Ӧ�Ѵ�ƽ�⣻C�����ڷ�Ӧǰ���������ʵ�����������ѹǿ֮�ȵ������ʵ���֮�ȣ���ѹǿ����ʱ��˵����Ӧ�Ѵ�ƽ�⣻D��CH3OH��CO2�����ʵ���֮��ȡ������ʼʱ������֮�ȣ�����������ϵ������ȣ����κ�ʱ��CH3OH��CO2�����ʵ���֮�ȶ����䣬����CH3OH��CO2�����ʵ���֮�ȱ��ֲ���ʱ����˵����Ӧ�Ѵ�ƽ�⡣��˱����ΪAC��
����ͼ���֪����������5-15min����DMC��Ũ�ȸı���0.5mol/L�����ݷ�Ӧ����ʽ����c(CO2)=0.5 mol/L�����ʱ����ڵ�ƽ����Ӧ����Ϊv(CO2) = ![]() =0.05mol��L-1��min-1���Ƚϼס�����������ʼ��������ʵ�����������ͬ�����£����߽�����ƽ������ȫ��Чƽ����ͼ����ʾ������ƽ��ʱc�� ƽ(DMC)=1.5 mol/L����n�� ƽ(CO2) = 1mol-1.5 mol/L��0.5L=0.25mol��������ƽ��ʱn�� ƽ(CO2) =0.2mol< n�� ƽ(CO2) =0.25mol��˵������������ڼ�������ƽ�������ƶ�����֪�÷�Ӧ��H4<0�����¶ȣ���ѧƽ�������ƶ�������T1��T2�����ڱ�������������¶ȶ���ȷ����ֻ��CO2�����ʵ����ȼ���������ͼ���֪��������ƽ��Ĺ��������ʱȼĿ죬��������DMC��Ũ�ȱȼĴ����ڸ÷�Ӧ�Ƿ��ȷ�Ӧ�������¶ȣ��ɼӿ췴Ӧ���ʣ���ƽ�����ƣ�ʹ�������Ũ�ȼ�С��������ͼ����ʾ���������С��V<0.5L������ѹ���ɼӿ췴Ӧ�������Ҹ÷�Ӧ��һ�����������С�ķ�Ӧ����ѹ�����ƶ�����Ӧ��ת��������������Ũ��������ͼ����ʾ�����Լס����������ķ�Ӧ��ƽ��ʱCO2��ת�����Ǽף�����
=0.05mol��L-1��min-1���Ƚϼס�����������ʼ��������ʵ�����������ͬ�����£����߽�����ƽ������ȫ��Чƽ����ͼ����ʾ������ƽ��ʱc�� ƽ(DMC)=1.5 mol/L����n�� ƽ(CO2) = 1mol-1.5 mol/L��0.5L=0.25mol��������ƽ��ʱn�� ƽ(CO2) =0.2mol< n�� ƽ(CO2) =0.25mol��˵������������ڼ�������ƽ�������ƶ�����֪�÷�Ӧ��H4<0�����¶ȣ���ѧƽ�������ƶ�������T1��T2�����ڱ�������������¶ȶ���ȷ����ֻ��CO2�����ʵ����ȼ���������ͼ���֪��������ƽ��Ĺ��������ʱȼĿ죬��������DMC��Ũ�ȱȼĴ����ڸ÷�Ӧ�Ƿ��ȷ�Ӧ�������¶ȣ��ɼӿ췴Ӧ���ʣ���ƽ�����ƣ�ʹ�������Ũ�ȼ�С��������ͼ����ʾ���������С��V<0.5L������ѹ���ɼӿ췴Ӧ�������Ҹ÷�Ӧ��һ�����������С�ķ�Ӧ����ѹ�����ƶ�����Ӧ��ת��������������Ũ��������ͼ����ʾ�����Լס����������ķ�Ӧ��ƽ��ʱCO2��ת�����Ǽף�����
(4)����ͼ���֪������Һ��pH=8ʱ��c(SO32-)��c(HSO3-)����c(OH-)��c(H+)��������Һ�и�����Ũ���ɴ�С��˳����c(Na+)��c(SO32-)��c(HSO3-)��c(OH-)��c(H+)��
��HSO3-����Һ�м��е���ƽ�⣬Ҳ��ˮ��ƽ�⣬�������еμ�CaCl2��Һʱ��������ӦCa2++ SO32-=CaSO3����ʹ�����ƽ��HSO3-![]() H++SO32-��c(SO32-)��С�������ƶ�������c(H+)����pH��С��
H++SO32-��c(SO32-)��С�������ƶ�������c(H+)����pH��С��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������Ǽ����л�������ƻ�ѧʽ��
��2��2��3���������顢��3������1�������顢�ۼױ�����![]() �� ��ClCH=CHCl����
�� ��ClCH=CHCl����![]() ��
�� ��
�� ��1��3��5������ϩ
��1��3��5������ϩ
�ݴ˻ش��������⣺
��1�������л����У���Ϊͬ���칹�����______���ñ�ű�ʾ��������˳���칹����______���ñ�ű�ʾ����
��2���Ԣ��л���Ϊԭ���Ʊ�TNTըҩ�Ļ�ѧ����ʽΪ______��
��3����֪���л�������У���ij��̼ԭ��������4����ͬ��ԭ�ӻ���ţ�������̼ԭ�ӳ�Ϊ������̼ԭ�������� �д�*��Cԭ����[��ͬһ��̼ԭ��������2��̼̼˫������C�TC�TC��ʱ�����Ӽ����ȶ��������ڡ�]��1��3��5������ϩ���ڶ�����ͬ���칹���У�����������̼ԭ��������������H2�����ӳɷ�Ӧ���Ծ���������̼ԭ������______�֣�����������̼ԭ��������������H2�����ӳɷ�Ӧ������������̼ԭ�����Ľṹ��ʽ��____��
�д�*��Cԭ����[��ͬһ��̼ԭ��������2��̼̼˫������C�TC�TC��ʱ�����Ӽ����ȶ��������ڡ�]��1��3��5������ϩ���ڶ�����ͬ���칹���У�����������̼ԭ��������������H2�����ӳɷ�Ӧ���Ծ���������̼ԭ������______�֣�����������̼ԭ��������������H2�����ӳɷ�Ӧ������������̼ԭ�����Ľṹ��ʽ��____��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������ǵ�����������Ҫ�Ļ�����Ʒ֮һ��
I.����ĸ����Ʒ���
��1������1000����ǰ,�ҹ����Ѳ��ü��ȵ���(CuSO4�� 5H2O)���̷�(FeSO4��7H2O)�ķ�����ȡ���ᡣFeSO4���ȷֽ�Ļ�ѧ����ʽ:2 FeSO4![]() Fe2O3+SO2�� +SO3����
Fe2O3+SO2�� +SO3����
�� ��FeSO4���Ȳ���������ͨ������ͼװ����,�Լ���������������Ƿ���SO3��SO2�� ��˵��SO2���ڵ�ʵ��������_________��

�� ��ͬѧ������߿���ʢװNaOH��Һ��װ�ÿ��Ի�����ͼ�ұߵ�aװ��,���ж�ײ������ݵ�������__________��
��2��Ŀǰ��ҵ����Ҫ���ýӴ����Ʊ�����,����һ��Ϊ:2SO2+O2![]() 2SO3��ʵ����ģ��ù��̳�����ͼװ�ý���ʵ�顣bװ����װ��Ũ����,д��bװ�õ�����__________(д������)��
2SO3��ʵ����ģ��ù��̳�����ͼװ�ý���ʵ�顣bװ����װ��Ũ����,д��bװ�õ�����__________(д������)��
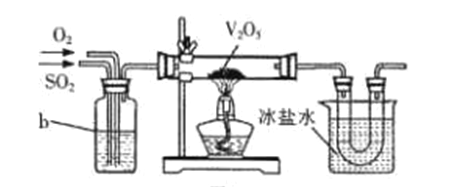
��.��������ʡ�
��3����ͼ�м��Թ��ڷ�����Ӧ�Ļ�ѧ����ʽ_________ ,�÷�Ӧ������Ũ���������Ϊ______��
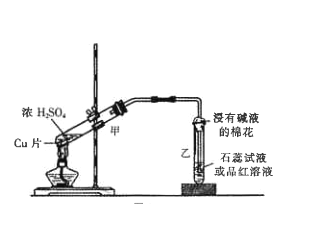
��4����ͭƬ��Ũ�����ַ�Ӧ��,�Թ��ڲ�δ������ɫ��Һ,���ǿ�����ɫ����,��д�������ɫ����ķ���______________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ʵ������������������
��� | ʵ�� | ���� |
A | ���ȷ��������е�С���� | �����ۻ��ɹ�����С��ȼ��ʱ������Ϊ��ɫ��ȼ�պ����ɵ���ɫ���� |
B | �ھƾ����ϼ�����ɰֽ��ĥ�������� | ����������ʧȥ�����ۻ������������� |
C | ��FeCl2��Һ�е���NaOH��Һ | ���ɰ�ɫ�����������ܿ��Ϊ����ɫ������Ϊ���ɫ |
D | ��ˮ����ͨ�����ȵ����� | ��ɫ��ĩ��Ϊ���ɫ |
A. A B. B C. C D. D
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ŵ���ǽ�����ʹ����ҩ����ṹ��ͼ��ʾ�������й�˵����ȷ����

A. ����ʽΪC17H14O5N
B. ��ŵ���ܷ���������Ӧ
C. 1 mol��ŵ����H2�����ӳɷ�Ӧ�������8mol H2
D. ����������ˮ��Һ��ˮ����Եõ�3���л�������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������(H2BO3)����ͨ�����NaB(OH)4��Һ�ķ����Ʊ�������ԭ����ͼ��ʾ�������йر���������ǣ� ��
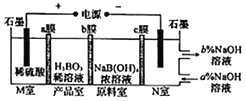
A. M�ҵĵ缫��ӦʽΪ2H2O-4e-=O2��+4H+
B. N����,���ںͳ��ڵ���ҺŨ�ȴ�С��ϵΪa%<b%
C. bĤΪ�����ӽ���Ĥ,��Ʒ�ҷ�����ӦΪH++[B(OH)4]-=H3BO3+H2O
D. ������ÿ����1molH3BO3,�����ҿ�����5.6L����(��״��)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����������Ȼ��������Ҫ�Ļ����Լ��������й��������£�
���Ȼ������۵�Ϊ306�棬�е�Ϊ315�棻�����տ����е�ˮ�ֶ����⡣��ҵ�ϲ�����500~600���������ͨ��������������ˮ�Ȼ�����
���Ȼ��������۵�Ϊ670�棬����������ҵ�ϲ��������������ͨ���Ȼ�����������ˮ�Ȼ�������
ij��ѧ�С������ͼ��ʾ��װ��(�г�װ����ȥ)ģ�ҵ�����Ʊ���ˮ�Ȼ�������ش��������⣺
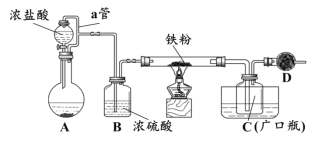
��1����װ��A�У���KMnO4��Ũ���ᷴӦ��ȡ��������Ӧ�����ӷ���ʽΪ_________������D��������__________________��
��2��D��װ��ҩƷ�Ǽ�ʯ�ң���������__________________________��
��3�����Է�����ȡװ��C�е�������������ϡ���������ϡ��Һ���á��������л���FeCl2�����������Լ��е�_____(ֻ��ѡȡһ���Լ��������)���м�⣬ʵ��������__________________________________��
��H2O2 ��Һ ��KI-������Һ ��KSCN��Һ ������KMnO4��Һ
��4������������ȡװ��C�еIJ�������²�����вⶨ���ٳ�ȡ4.60g��Ʒ���ڹ�����ϡ�����У��ڼ�������H2O2��Һ�����ټ�������NaOH��Һ���ܹ��ˡ�ϴ�Ӻ����ճ������ݳ������ú���ɫ����Ϊ2.40g��
�����Ʒ����Ԫ�ص���������Ϊ_______%(�����ȷ��С�������λ)��
��5���ɣ�4�������������ݵó����ۣ�������Ľ���ʩ��
������Ŀ������װ���ƵõIJ����У���Ԫ�غ���______(���ȡ�����ƫ�ߡ���ƫ�͡�)��˵������FeCl2���ʡ�
����Ҫ�õ��ϴ�������ˮ�Ȼ������ɲ�ȡ�ġ�װ�á��Ľ���ʩ��_________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijУ��ѧ��ȤС���ͬѧ�Ժ�������Na2SO4��NaOH��Ʒ��NaOH�ĺ������вⶨ���ش���������:
��1����ͬѧ���ó������ⶨ��Ʒ��NaOH�ĺ�������ͬѧѡ�õ�ҩƷ����Ʒ������ˮ��MgCl2��Һ����Ҫ�ⶨ��ʵ��������__________��
��2����ͬѧ�����к͵ζ����ⶨ��Ʒ��NaOH�ĺ�����
���÷�����ƽȷ��ȡ����Ʒ5.0000 g��ȫ������ˮ���Ƴ�1000.0 mL��Һ���ü�ʽ�ζ�����ȡ20.00 mL������Һ������ƿ�У��μӼ���ָʾ�������⡣�ζ�����ʹ��ǰ��ϴ���⣬��Ӧ____________________________________��
����Ũ��Ϊ0.100 0 mol��L��1���������Һ���еζ�����ʼ�ζ�ǰ��һ��������________��
�۵ζ���������pH�Ʋⶨ��ƿ����Һ��pH���ٽ��ζ��յ�ʱ�ⶨpHӦÿ��һ�β�һ�Ρ�
�ܵζ������У���ƿ����Һ��pH�仯���£�
V(HCl)/mL | 0.00 | 12.00 | 18.00 | 22.00 | 23.00 | 23.96 | 24.00 | 24.04 | 25.00 | 26.00 | 30.00 |
pH | 13.1 | 12.6 | 12.2 | 11.7 | 11.4 | 9.9 | 7.0 | 4.0 | 2.7 | 2.4 | 1.9 |
��������ͼ�л��Ƴ������к͵ζ������ߡ�______________

�������ʾ�Ǽ������ָʾ���ı�ɫ��Χ���������������к͵ζ����߷����������к͵ζ���Ӧѡ�õ�ָʾ����________��
ָʾ�� | ��ɫ��Χ(pH) | ��ɫ | |
�� | �� | ||
���� | 3.1��4.4 | �� | �� |
ʯ�� | 5.0��8.0 | �� | �� |
��̪ | 8.2��10.0 | �� | �� |
����Ʒ�У�NaOH�������ٷֺ���Ϊ____________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������ӵ�������ֵΪNA������˵����ȷ����
A. ��״���£�2.24LCH3OH�����й��ۼ�����ĿΪ0.5NA
B. 1molNa2O2������CO2��ַ�Ӧ��ת�Ƶĵ�����Ϊ2 NA
C. 25��1LpH=12��Na2CO3��Һ�У���ˮ�����H+����ĿΪ0.01NA
D. 0.1molH2��0.1molI2���ܱ������г�ַ�Ӧ��HI��������Ϊ0.2NA
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com