

| ||
| 36g |
| 100g+36g |
| 8.775g |
| 52.81g |


 精英口算卡系列答案
精英口算卡系列答案 应用题点拨系列答案
应用题点拨系列答案 状元及第系列答案
状元及第系列答案科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 碳、氮、氧是构成生命物质的三种主要元素.
碳、氮、氧是构成生命物质的三种主要元素.查看答案和解析>>
科目:高中化学 来源: 题型:
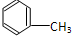 C:CH3CH2OH
C:CH3CH2OH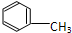 在浓硫酸作用下,与浓硝酸共热至100℃反应的化学方程式为:
在浓硫酸作用下,与浓硝酸共热至100℃反应的化学方程式为:查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、PH小于7的雨水称为酸雨 |
| B、空气中直径大于2.5μm的颗粒物称为PM2.5 |
| C、分散质粒子直径介于1nm~100nm之间的分散系称为胶体 |
| D、标况下的气体摩尔体积为22.4L |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com