
| 5+3 |
| 2 |
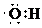 ����ҵ�����õ�ⱥ��ʳ��ˮ����NaOH���������÷�Ӧ�Ļ�ѧ����ʽΪ2NaCl+2H2O
����ҵ�����õ�ⱥ��ʳ��ˮ����NaOH���������÷�Ӧ�Ļ�ѧ����ʽΪ2NaCl+2H2O
| ||
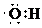 ��2NaCl+2H2O
��2NaCl+2H2O
| ||


 �ƸԴ��ž�ϵ�д�
�ƸԴ��ž�ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A��CH3COOH=CH3COO-+H+ |
| B��H2SO4=2H++SO42- |
| C��Ba��OH��2=Ba2++��OH-��2 |
| D��KHCO3=K++H++CO32- |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A | B | C | D | |
| ������ | HCl | NaOH | Cu2��OH��2SO4 | FeSO4*7H2O |
| ������ | H2O | Na2O�� | CO�� | Fe3O4 |
| ����� | Ũ���� | ����� | �������� | �� |
| A��A | B��B | C��C | D��D |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A����Һ | B������Һ |
| C������ | D������Һ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
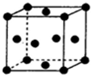 A��B��C��D��E��F��ԭ���������ε�����ǰ������Ԫ�أ�����C��Eͬ���壬��E��ԭ��������C��������A�ֱ���B��C�����γ�10���ӷ��ӣ�B��C������������֮��2��3��Fԭ�ӵ�������������A��ͬ��������������������������D2C2��ˮ��Ӧ����C�ĵ��ʣ�����Һ��ʹ��̪��Һ�ȱ�����ɫ���ݴ˻ش��������⣺
A��B��C��D��E��F��ԭ���������ε�����ǰ������Ԫ�أ�����C��Eͬ���壬��E��ԭ��������C��������A�ֱ���B��C�����γ�10���ӷ��ӣ�B��C������������֮��2��3��Fԭ�ӵ�������������A��ͬ��������������������������D2C2��ˮ��Ӧ����C�ĵ��ʣ�����Һ��ʹ��̪��Һ�ȱ�����ɫ���ݴ˻ش��������⣺�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A��������̼��ˮ��Һ�ܵ��磬���Զ�����̼�ǵ���� |
| B��1mol?L-1����������Һ��1mol?L-1������������Һ���ֱ���������ʵ�飬������Һ�ĵ����Բ�ͬ |
| C���������������ܵ��磬���������������ǵ���� |
| D������ͬ�¶��£�������Һһ���Ȳ�������Һ�ĵ�����ǿ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A�����������ڴ������ܽ������ݲ�����CaCO3+2H+=Ca2++H2O+CO2�� |
| B��CuSO4��Һ�м�������Ba��OH��2��Һ��SO42-+Ba2+=BaSO4 |
| C����Cu˿����AgNO3��Һ�У�Cu+Ag+=Cu2++Ag |
| D����С�մ�NaHCO3����θ����ࣺHCO3-+H+=H2O+CO2�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
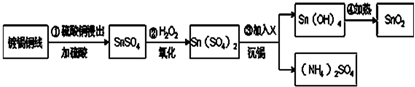
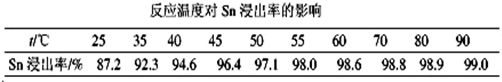
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| t/s | 0 | 2 | 4 | 6 | 8 |
| n��Cl2��/mol | 0 | 0.16 | 0.19 | 0.20 | 0.20 |
| A����Ӧ��ǰ2 s ��ƽ������v��CO��=0.080mol?L-1?s-1 |
| B�����������������䣬�����¶ȣ�ƽ��ʱc��Cl2��=0.11 mol?L-1��������ӦΪ���ȷ�Ӧ |
| C���������г���0.9 mol COCl2��0.10 mol Cl2��0.10 mol CO����Ӧ�ﵽƽ��ǰv����v�� |
| D������ʼ�������г���1.0 mol Cl2 ��0.9 mol CO���ﵽƽ��ʱ��Cl2��ת���ʴ���80% |
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com