
【题目】化学与生活、社会、科技关系密切。下列解释正确的是![]()
![]()
A.夏天雷雨过后空气清新的主要原因是放电时![]() 和
和![]() 合成了NO
合成了NO
B.加碘盐中添加的是![]()
C.“碳海绵”吸收泄漏的原油时发生了化学变化
D.二氧化硫有毒,不能作为食品添加剂
 口算题卡北京妇女儿童出版社系列答案
口算题卡北京妇女儿童出版社系列答案科目:高中化学 来源: 题型:
【题目】在![]() 溶液中加入
溶液中加入![]() ,调节溶液
,调节溶液![]() ,可以得到不同沉淀。
,可以得到不同沉淀。![]() ,得到沉淀
,得到沉淀![]() ;
;![]() ,得到沉淀
,得到沉淀![]() 。
。![]() 在氧气中加热升温过程中固体的质量变化如图:
在氧气中加热升温过程中固体的质量变化如图:
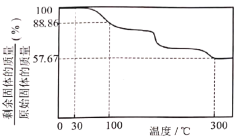
(1)配制![]() 溶液时,不能将
溶液时,不能将![]() 固体直接溶于水,而是将固体溶于浓硝酸中,然后加水稀释,其目的是______________。
固体直接溶于水,而是将固体溶于浓硝酸中,然后加水稀释,其目的是______________。
(2)![]() 在热水中会与水反应生成
在热水中会与水反应生成![]() ,该反应的化学方程式是____________。
,该反应的化学方程式是____________。
(3)![]() 在足量的氧气中加热至300℃时,所得的固体残留物为
在足量的氧气中加热至300℃时,所得的固体残留物为![]() ,测得所得气体中仅含有
,测得所得气体中仅含有![]() 、______和______等三种气体(填化学式)。
、______和______等三种气体(填化学式)。
(4)根据以上实验数据计算,确定![]() 中x的值_______ (写出计算过程)。
中x的值_______ (写出计算过程)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,向圆底烧瓶中加入1 molC2H5OH和含1molHBr的氢溴酸,溶液中发生反应;C2H5OH+HBr![]() C2H5Br+H2O,充分反应后达到平衡。已知常压下,C2H5Br和C2H5OH的沸点分别为38.4℃和78.5℃。下列有关叙述错误的是
C2H5Br+H2O,充分反应后达到平衡。已知常压下,C2H5Br和C2H5OH的沸点分别为38.4℃和78.5℃。下列有关叙述错误的是
A. 加入NaOH,可增大乙醇的物质的量
B. 增大HBr浓度,有利于生成C2H5Br
C. 若反应物增大至2 mol,则两种反应物平衡转化率之比不变
D. 若起始温度提高至60℃,可缩短反应达到平衡的时间
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,向1L 0.1mol/L的一元酸HR溶液中逐渐通入氨气(已知25℃时一水合氨的电离平衡常数为K=1.76×10-5),保持溶液的温度和体积不变,混合溶液的pH与粒子浓度比值的对数变化关系如图所示。下列叙述错误的是
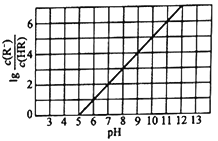
A. 25℃时,0.1mol/L的一元酸HR的电离平衡常数为Ka=10-5
B. 当通入0.1mol氨气时,c(NH4+)>c(R-)>c(OH-)>c(H+)
C. 当c(R-)=c(HR) 时,溶液为酸性
D. HR为弱酸,25℃时随着氨气的通入,c (R-)/[c(OH)c (HR)] 逐渐增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮元素是一种重要的非金属元素,可形成多种化合物。试回答下列有关问题:
(1)①已知4CO(g)+2NO2(g) ![]() 4CO2(g)+N2(g) ΔH=-1 200 kJ·mol-1对于该反应,改变某一反应条件,(已知温度T2>T1)下列图像正确的是_______(填代号)
4CO2(g)+N2(g) ΔH=-1 200 kJ·mol-1对于该反应,改变某一反应条件,(已知温度T2>T1)下列图像正确的是_______(填代号)

②已知CO与H2O在一定条件下可以发生反应:CO(g)+H2O(g)![]() CO2(g)+H2(g) ΔH= - Q kJ·mol-1 ,820 ℃时在甲、乙两个恒容密闭容器中,起始时按照下表进行投料,经过一段时间后达到平衡状态,若甲中CO的转化率为40%,则该反应的平衡常数为____________;乙容器吸收的热量为________________。
CO2(g)+H2(g) ΔH= - Q kJ·mol-1 ,820 ℃时在甲、乙两个恒容密闭容器中,起始时按照下表进行投料,经过一段时间后达到平衡状态,若甲中CO的转化率为40%,则该反应的平衡常数为____________;乙容器吸收的热量为________________。
![]()
(2)肼可作为火箭发动机的燃料,与氧化剂N2O4反应生成N2和水蒸气,已知:
① N2 (g) +2O2 (g) = N2O4 (l) ΔH =-19.5 kJ·mol-1
② N2H4(l)+O2(g) = N2(g) +2H2O(g) ΔH =-534.2 kJ·mol-1
写出肼与四氧化二氮反应的热化学方式______________。
(3)纯的叠氮酸(HN3)是无色液体,常用做引爆剂,常温下向25 mL 0.1mol·L-1 NaOH溶液中加入0. 2mol·L-1 HN3的溶液,滴加过程中的pH值的变化曲线(溶液混合时的体积变化忽略不计)如图。

①根据图像写出HN3的电离方程式:_________。
②下列说法正确的是_________________(填序号)
A.若用已知浓度的NaOH溶液滴定HN3溶液来测定HN3的浓度时应用甲基橙作指示剂
B.常温下,向0.2 mol·L-1 HN3的溶液中加水稀释,则![]() 不变
不变
C.分别中和pH均为4的HN3溶液和HCl溶液,消耗0.1 mol·L-1 NaOH溶液的体积相同
D.D点时溶液中离子浓度存在如下关系:2c(H+) + c(HN3) =c(N3-) + 2c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用磁铁矿(主要成分Fe3O4、含Al2O3和SiO2等杂质),制取FeCO3的工艺流程如下:
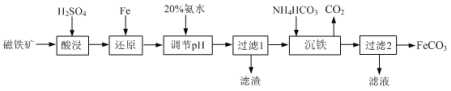
(1)“酸浸”时Fe3O4发生反应的离子反应方程式为 _______ 。
(2)“酸浸”过程中加入过量硫酸的目的是 _______ 和 _______ 。
(3)当溶液中金属离子浓度小于10-5mol·L-1时,则认为金属离子沉淀完全。若还原反应后溶液中c(Fe2+)=0.1 mol·L-1,则常温下加入20%氨水应调pH的范围为 _______ 。{已知:Ksp[Fe(OH)2]=1×10-17,Ksp[Al(OH)3]=1×10-32}
(4)“过滤1”所得滤渣除Fe、Al(OH)3外还有 _______ 。
(5)“沉铁”反应的离子方程式为: _______ 。
(6)若将“沉淀”试剂NH4HCO3改成Na2CO3,则溶液的混合方式为 _______ (填字母)。
A 向“过滤1”的滤液中滴加Na2CO3溶液,并充分搅拌
B 向Na2CO3溶液中滴加“过滤1”的滤液,并充分搅拌
C “过滤1”的滤液和Na2CO3溶液同时加入,并充分搅拌
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学利用浓度相同的氯水、Cl2的CCl4溶液完成下述实验。下列有关实验的说法中,不正确的是
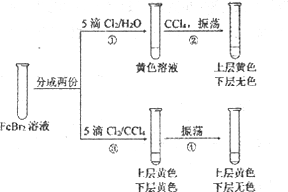
A. 操作④中发生的反应是Br2+ 2Fe2+=2Br-+2Fe3+
B. 操作②和操作④之后,试管上层溶液的成分相同
C. 操作①后的溶液中没有Br2,但反应过程中可能有Br2生成
D. 实验说明,CCl4影响了Cl2、Br2和Fe3+氧化性的强弱顺序
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】取纯净![]() 固体用如下方法制备
固体用如下方法制备![]() 。
。
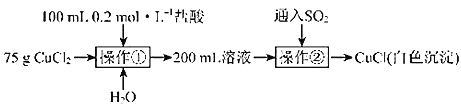
(4)操作②中反应的离子方程式为_________。
(5)操作①中若用![]() 盐酸代替
盐酸代替![]() 盐酸,再通入
盐酸,再通入![]() 后,无白色沉淀产生。对此现象有如下两种猜想:
后,无白色沉淀产生。对此现象有如下两种猜想:
猜想一:![]() 过大导致白色沉淀溶解。为验证此猜想,取75gCuCl2固体、
过大导致白色沉淀溶解。为验证此猜想,取75gCuCl2固体、![]() 盐酸及________
盐酸及________![]() 配制
配制![]() 溶液,再进行操作②,观察是否有白色沉淀产生。
溶液,再进行操作②,观察是否有白色沉淀产生。
猜想二:____________。为验证此猜想,取少量白色沉淀加入饱和氯化钠溶液中,搅拌,观察白色沉淀是否溶解。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CO2和CH4催化重整可制备合成气,对减缓燃料危机具有重要的意义,其反应历程示意图如图:
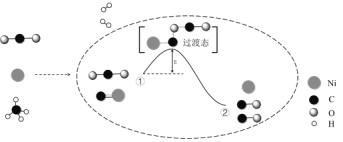
下列说法中错误的是( )
A.过程①→②是吸热反应
B.Ni是该反应的催化剂
C.过程①→②既有碳氧键的断裂,又有碳氧键的形成
D.反应的总化学方程式可表示为:CH4+CO2![]() 2CO+2H2
2CO+2H2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com