
| A. | 硫酸与氯化钠反应 | B. | 硝酸银溶液中滴加稀氨水 | ||
| C. | 铁在硫蒸气中燃烧 | D. | 铁粉加入硝酸中 |
科目:高中化学 来源: 题型:选择题
| A. | 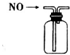 装置可收集NO气体 | |
| B. |  装置可吸收多余氨气且能防止倒吸 | |
| C. |  装置可实现反应:2H2O$\frac{\underline{\;通电\;}}{\;}$2H2↑+O2↑ | |
| D. | 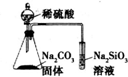 装置可证明非金属性:S>C>Si |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
 室温下,将1.000 mol/L 盐酸滴入20.00 mL 1.000 mol/L 氨水中,溶液pH 和温度随加入盐酸体积变化曲线如图所示.下列有关说法正确的是 ( )
室温下,将1.000 mol/L 盐酸滴入20.00 mL 1.000 mol/L 氨水中,溶液pH 和温度随加入盐酸体积变化曲线如图所示.下列有关说法正确的是 ( )| A. | a 点由水电离出的c(H+)=1.0×10-14 mol/L | |
| B. | b:c (NH4+)+c(NH3•H2O)>c(Cl-) | |
| C. | c点:c(Cl-)=c(NH4+) | |
| D. | d点后,溶液温度略有下降的主要原因是NH3•H2O电离吸热 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1molNa2O2所含的阴离子 | |
| B. | 1L0.1mol•L-1氨水中的NH4+ | |
| C. | 12.5mL16mol•L-1的浓硫酸能溶解的Cu | |
| D. | 4.6gNO2气体所含的分子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 电子由铁极经溶液向铂极迁移 | |
| B. | 放电过程中交换膜右侧溶液颜色逐渐变浅 | |
| C. | 正极的电极反应式为Fe3++3e-=Fe | |
| D. | 若转移2mole-,交换膜右侧溶液中约减少3 mol离子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径:乙>丙>丁 | |
| B. | 单质的还原性:丁>丙>甲 | |
| C. | 乙、丙、丁的最髙价氧化物对应的水化物能相互反应 | |
| D. | 甲、乙、丙的氧化物均为共价化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

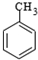 $\stackrel{KMnO_{4}/H+}{→}$
$\stackrel{KMnO_{4}/H+}{→}$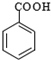
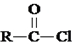
 .
.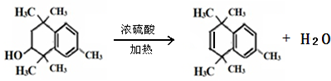 .
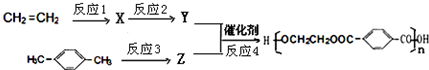
.
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
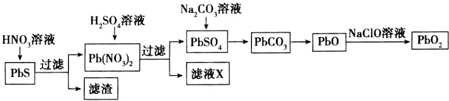
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com