
【题目】汽车尾气和燃煤尾气是造成空气污染的重要原因之一,治理汽车尾气和燃煤尾气是环境保护的重要课题。回答下列问题:
(1)煤燃烧产生的烟气中含有氮的氧化物,用CH4催化还原NO2可消除氮氧化物的污染。已知:
①CH4(g)+ 2NO2(g)= N2(g)+CO2(g)+2H2O(g) △H=-867.0kJ/mol;
②N2(g)+2O2(g)= 2NO2(g) △H=+67.8 kJ/mol;
③N2(g)+O2(g)=2NO(g) △H=+89.0 kJ/mol
则CH4催化还原NO的热化学方程式为__________________________________。
(2)在汽车排气系统中安装三元催化转化器,可发生反应:2NO(g)+2CO(g) ![]() 2CO2(g)+N2(g)。在某密闭刚性容器中通入等量的CO和NO,发生上述反应时,c(CO)随温度(T)和时间(t)的变化曲线如图所示。
2CO2(g)+N2(g)。在某密闭刚性容器中通入等量的CO和NO,发生上述反应时,c(CO)随温度(T)和时间(t)的变化曲线如图所示。

①据此判断该反应的正反应为____(填“放热”或“吸热”)反应。
②温度T1时,该反应的平衡常数K=_____;反应速率v=v正-v逆=k正c2(NO)c2(CO)-k逆c2(CO2)c(N2),k正、k逆分别为正、逆反应速率常数,计算a处![]() =________。
=________。
(3)SNCR-SCR脱硝技术是一种新型的除去烟气中氮氧化物的脱硝技术,一般采用氨气或尿素作还原剂,其基本流程如图:

①SNCR-SCR脱硝技术中用NH3作还原剂还原NO的主要反应为4NH3(g)+4NO(g)+O2(g)=4N2(g)+6H2O(g),△H<0,则用尿素[CO(NH2)2]作还原剂还原NO2的化学方程式为____________。
②体系温度直接影响SNCR技术的脱硝效率,如图所示:

SNCR与SCR技术相比,SCR技术的反应温度不能太高,其原因是__________;当体系温度约为925℃时,SNCR脱硝效率最高,其可能的原因是______________。
【答案】CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g) △H=-977.2kJ/mol 放热 80 648 4CO(NH2)2+6NO2![]() 4CO2+7N2+8H2O 温度太高,会降低催化剂活性 低于925℃反应速率较慢,高于925℃不利于脱硝反应正向进行
4CO2+7N2+8H2O 温度太高,会降低催化剂活性 低于925℃反应速率较慢,高于925℃不利于脱硝反应正向进行
【解析】
(1) CH4(g)+ 2NO2(g)= N2(g)+CO2(g)+2H2O(g) △H=-867.0kJ/mol;
②2N2(g)+2O2(g)= 2NO2(g) △H=+67.8 kJ/mol;
③N2(g)+O2(g)=2NO(g) △H=+89.0 kJ/mol
利用盖斯定律计算①+②-③×2得到CH4催化还原NO的热化学方程式;
(2)①根据先拐先平温度高,T1>T2,纵轴温度越高CO浓度越大,说明升温平衡逆向进行;
②温度为T1时,化学平衡常数的的含义,利用三段式计算出各种物质的平衡浓度,将各种物质的平衡浓度带入公式可得其平衡常数的数值;速率常数只与温度有关,温度不变,速率常数不变,根据平衡时v正= v逆,可得![]() =K,根据v正=k正c2(NO)c2(CO),v逆=k逆c2(CO2)c(N2),代入
=K,根据v正=k正c2(NO)c2(CO),v逆=k逆c2(CO2)c(N2),代入![]() 即可计算出其数值;
即可计算出其数值;
(3)①尿素[CO(NH2)2]作还原剂还原NO2,反应生成氮气、二氧化碳和水;
②脱硝的最佳温度约为925℃,此时脱硝效率最大,SNCR与SCR技术相比,SNCR技术的反应温度较高是因为未加入催化剂,从催化剂活性分析温度的影响;从平衡移动角度及反应速率选择合适的温度。
(1)①CH4(g)+ 2NO2(g)= N2(g)+CO2(g)+2H2O(g) △H=-867.0kJ/mol;
②2N2(g)+2O2(g)= 2NO2(g) △H=+67.8 kJ/mol;
③N2(g)+O2(g)=2NO(g) △H=+89.0 kJ/mol
利用盖斯定律计算①+②-③×2得到CH4催化还原NO的热化学方程式CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g) △H= -977.2 kJ/mol;
(2)①先拐先平温度高,T1>T2,纵轴温度越高CO浓度越大,说明升温平衡逆向进行,则该反应的正反应为放热反应,△H<0;
②在某密闭容器中通入等量的CO和NO,根据图象可知开始时,c(CO)=c(NO)= 2mol/L,平衡状态下一氧化碳浓度为0.4mol/L,
2NO(g)+2CO(g) ![]() 2CO2(g)+N2(g)
2CO2(g)+N2(g)
起始量(mol/L) 2 2 0 0
变化量(mol/L) 1.6 1.6 1 .6 0.8
平衡量(mol/L) 0.4 0.4 1.6 0.8
根据平衡常数的含义可得该温度下的反应平衡常数K=![]() =80;
=80;
当该可逆反应达到平衡时v正= v逆,根据v=v正-v逆=k正c2(NO)c2(CO)-k逆c2(CO2)c(N2),可得![]() =K,根据v正=k正c2(NO)c2(CO),v逆=k逆c2(CO2)c(N2),在a点,c(NO)=c(CO)=1.2mol/L,根据物质反应时的物质的量关系可知,此时c(CO2)=0.8mol/L,c(N2)= 0.4mol/L,则
=K,根据v正=k正c2(NO)c2(CO),v逆=k逆c2(CO2)c(N2),在a点,c(NO)=c(CO)=1.2mol/L,根据物质反应时的物质的量关系可知,此时c(CO2)=0.8mol/L,c(N2)= 0.4mol/L,则![]() =
=![]() =
=![]() =648;
=648;
(3)①尿素[CO(NH2)2]作还原剂还原NO2,反应生成氮气、二氧化碳和水,反应的化学方程式为:4CO(NH2)2+6NO2![]() 4CO2+7N2+8H2O;
4CO2+7N2+8H2O;
②图象可知SNCR技术的脱硝的最佳温度为:925°C左右,但温度也不能太高,这是因为温度低,反应速率慢,但温度太高, 会降低催化剂活性;当体系温度约为925℃C时,SNCR脱硝效率最高,其可能的原因是温度较低时,化学反应速率慢,达到平衡所需的时间过长,生产效率低下,温度过高,催化剂活性降低,且升高温度有利于反应向吸热的逆反应方向方向进行,不利于脱硝技术消除烟气中的氮氧化物。


科目:高中化学 来源: 题型:
【题目】废气中的含氮氧化物是主要的大气污染物,因此脱出废气中的含氮氧化物对于保护大气环境具有重要的意义。
(1)汽车的大量使用是城市大气中含氮氧化物的主要来源。
①汽车燃油中一般不含有氮元素,汽车尾气中的NO是如何产生的?___________(用化学方程式表示)。
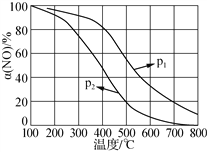
②NO易被O2氧化为NO2。其他条件不变时,NO的氧化率[α(NO)%]与温度、压强的关系如图所示。则p1________p2(填“>”、“<”或“=”);温度高于800℃时,α(NO)几乎为0的原因是_____。
(2)利用氨气脱除NO是大气污染防治研究的热点,过程中涉及的反应为:
主反应:4NH3(g)+4NO(g)+O2(g)![]() 4N2(g)+6H2O(g)
4N2(g)+6H2O(g)
副反应:
①4NH3(g)+5O2(g)![]() 4NO(g)+6H2O(g) ΔH=-905.5kJ/mol
4NO(g)+6H2O(g) ΔH=-905.5kJ/mol
②4NH3(g)+4O2(g)![]() 2N2O(g)+6H2O(g) ΔH=-1104.9kJ/mol
2N2O(g)+6H2O(g) ΔH=-1104.9kJ/mol
③4NH3(g)+3O2(g)![]() 2N2(g)+6H2O(g) ΔH=-1269.0kJ/mol
2N2(g)+6H2O(g) ΔH=-1269.0kJ/mol
回答下列问题:
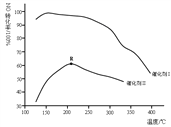
主反应的ΔH为____________________;保持其它条件相同,使用两种不同的催化剂,主反应NO的转化率与温度关系如图所示,选用催化剂I的优势有_________________(写出一点即可);R点对应的温度为210℃,低于210℃,NO的转化率是不是对应温度下的平衡转化率,请作出判断并写出理由__________________。
(3)碱液吸收法:用Na2CO3溶液吸收NO2生成CO2.若每4.6gNO2和Na2CO3溶液反应时转移电子数为0.05mol,则反应的离子方程式是__________。
(4)常温下,在通入O2的条件下用0.1mol/L的NaOH溶液吸收NO,产物为NaNO3 和NaNO2。已知反应后溶液的pH=12,溶液中NO2-浓度为5.6×10-2mol/L(忽略反应过程中溶液体积变化,HNO2的电离平衡常数Ka=5.1×10-4),则:
①![]() =________mol/L
=________mol/L
②反应后溶液中NO3-的浓度约为___________mol/L
③某溶液中c(NO2-)=1.0×10-6mol/L,取该溶液5mL,加入一滴0.1mol/L硝酸银溶液(一滴为0.05mL),通过计算说明能否产生沉淀______________。(Ksp(AgNO2)=2×10-8)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钠电池由于其快速充放电的特性受到科研工作者的重视,某钠离子钛基电池电池结构如图所示,电解质为含钠离子的高聚物,已知电池的反应方程式为2NaxCn+xNaTi2(PO4)3![]() 2nC+ xNa3Ti2(PO4)3。下列关于该电池说法正确的是
2nC+ xNa3Ti2(PO4)3。下列关于该电池说法正确的是

A. 放电时电池正极为NaxCn B. 放电时Na+向电极Ⅱ移动
C. 充电时阳极反应:NaxCn-xe-=nC+xNa+ D. 充电时电极Ⅰ与外电源正极相连
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一绝热(不与外界发生热交换)的恒容容器中,发生反应:2A(g)+B(s) ![]() C(g)+D(g),下列描述中能表明反应已达到平衡状态的有( )个
C(g)+D(g),下列描述中能表明反应已达到平衡状态的有( )个
①容器内温度不变 ②混合气体的密度不变 ③混合气体的压强不变
④混合气体的平均相对分子质量不变 ⑤C(g)的物质的量浓度不变
⑥容器内A、C、D三种气体的浓度之比为2:1:1 ⑦某时刻v(A)=2v(C)且不等于零
⑧单位时间内生成n mol D,同时生成2n mol A
A. 4 B. 5 C. 6 D. 7
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国古代青铜器工艺精湛,有很高的艺术价值和历史价值,但出土的青铜器大多受到环境腐蚀,故对其进行修复和防护具有重要意义。研究发现,青铜器在潮湿环境中发生电化学腐蚀的原理示意图如下,下列说法正确的是

A. 腐蚀过程中,青铜基体是正极
B. CuCl在腐蚀过程中降低了反应的焓变
C. 若生成4.29 g Cu2(OH)3Cl,则理论上耗氧体积为0.448L
D. 将糊状Ag2O涂在被腐蚀部位,可以防止青铜器进一步被腐蚀,Ag2O与催化层发生复分解反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在密闭容器中将2molNaHCO3(s)和一定量Na2O2混合,在加热条件下让其充分反应,150℃下所得气体仅含2种组分,反应后固体的物质的量(n)的取值范围是( )
A. n≥1 B. 1<n<2 C. 2≤n<4 D. n≥4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】次磷酸(H3PO2)是一种精细化工产品,具有较强还原性,回答下列问题:
(1)H3PO2是一元中强酸,写出其电离方程式:___________。
(2)H3PO2及NaH2PO2均可将溶液中的银离子还原为银单质,从而可用于化学镀银.
①(H3PO2)中,磷元素的化合价为___________。
②利用(H3PO2)进行化学镀银反应中,氧化剂与还原剂的物质的量之比为4:1,则氧化产物为:___________(填化学式);
③NaH2PO2是 正盐还是酸式盐?___________,其溶液显___________性(填“弱酸性”、“中性”、或者“弱碱性”)。
(3)H3PO2的工业制法是:将白磷(P4)与氢氧化钡溶液反应生成PH3气体和Ba(H2PO2)2,后者再与硫酸反应,写出白磷与氢氧化钡溶液反应的化学方程式___________。
(4)(H3PO2)也可以通过电解的方法制备.工作原理如图所示(阳膜和阴膜分别只允许阳离子、阴离子通过):

①写出阳极的电极反应式___________;
②分析产品室可得到H3PO2的原因___________;
③早期采用“三室电渗析法”制备H3PO2,将“四室电渗析法”中阳极室的稀硫酸用H3PO2稀溶液代替,并撤去阳极室与产品室之间的阳膜,从而合并了阳极室与产品室,其缺点是___________杂质。该杂质产生的原因是___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】
金属铁及其化合物在材料、航空工业上有重要用途。回答下列相关问题:
(1)基态钛原子中有__________个状态不同的电子,最高能层电子的电子云轮廓图形状为__________,写出其价电子的轨道表达式__________。
(2)化合物TiO2不仅是常用的白色颜料,也是一些反应的良好催化剂,如:

有机物X中C原子的杂化轨道类型为__________,1mol Y中所含σ键的数目是__________。
(3)已知TiCl4在常温下是无色液体,TiCl4的晶体类型是__________晶体,其空间构型是__________。
(4)自然界中有丰富的钛矿资源,如右图表示的是钡钛矿晶体的晶胞结构,经X射线分析,该晶胞为正方体,晶胞参数为apm。
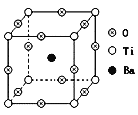
写出钡钛矿晶体的化学式__________,其密度是__________g·cm-3。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com