
【题目】
金属铁及其化合物在材料、航空工业上有重要用途。回答下列相关问题:
(1)基态钛原子中有__________个状态不同的电子,最高能层电子的电子云轮廓图形状为__________,写出其价电子的轨道表达式__________。
(2)化合物TiO2不仅是常用的白色颜料,也是一些反应的良好催化剂,如:

有机物X中C原子的杂化轨道类型为__________,1mol Y中所含σ键的数目是__________。
(3)已知TiCl4在常温下是无色液体,TiCl4的晶体类型是__________晶体,其空间构型是__________。
(4)自然界中有丰富的钛矿资源,如右图表示的是钡钛矿晶体的晶胞结构,经X射线分析,该晶胞为正方体,晶胞参数为apm。
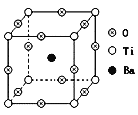
写出钡钛矿晶体的化学式__________,其密度是__________g·cm-3。
【答案】22 球形 ![]() sp3、sp2 16NA 分子 正四面体 BaTiO3 233/(a×10-10)3·NA
sp3、sp2 16NA 分子 正四面体 BaTiO3 233/(a×10-10)3·NA
【解析】
(1)钛原子的核电荷数为22,其核外共有22个运动状态不同的电子,钛原子的价电子排布式为3d24s2,则价电子排布图为![]() ,最高能层电子的电子云轮廓图形状为球形,;故答案为:22;球形;
,最高能层电子的电子云轮廓图形状为球形,;故答案为:22;球形; ![]() ;
;
(2)有机物X(![]() )中C原子有2种类型,其中甲基进而亚甲基中的碳原子均采用sp3杂化,羰基中的碳原子采用sp2杂化,单键是1个σ键,双键是1个σ键和1个π键,1molY(
)中C原子有2种类型,其中甲基进而亚甲基中的碳原子均采用sp3杂化,羰基中的碳原子采用sp2杂化,单键是1个σ键,双键是1个σ键和1个π键,1molY(![]() )中所含σ键的数目是16NA,故答案为:sp3、sp2;16NA;
)中所含σ键的数目是16NA,故答案为:sp3、sp2;16NA;
(3)已知TiCl4在常温下是无色液体,说明其熔沸点较低,则TiCl4属于分子晶体,其中Ti采用sp3杂化,空间构型为正四面体,故答案为:分子晶体;正四面体;
(4)由结构可知,Ba位于体心有1个,Ti位于顶点,数目为8×![]() =1个,O位于棱心,数目为12×
=1个,O位于棱心,数目为12×![]() =3个,故其化学式为BaTiO3;在每个晶胞中含有一个BaTiO3,质量为
=3个,故其化学式为BaTiO3;在每个晶胞中含有一个BaTiO3,质量为![]() g;晶体密度ρ=
g;晶体密度ρ=![]() =
=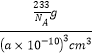 =
=![]() g/cm3,故答案为:BaTiO3;
g/cm3,故答案为:BaTiO3;![]() 。
。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】汽车尾气和燃煤尾气是造成空气污染的重要原因之一,治理汽车尾气和燃煤尾气是环境保护的重要课题。回答下列问题:
(1)煤燃烧产生的烟气中含有氮的氧化物,用CH4催化还原NO2可消除氮氧化物的污染。已知:
①CH4(g)+ 2NO2(g)= N2(g)+CO2(g)+2H2O(g) △H=-867.0kJ/mol;
②N2(g)+2O2(g)= 2NO2(g) △H=+67.8 kJ/mol;
③N2(g)+O2(g)=2NO(g) △H=+89.0 kJ/mol
则CH4催化还原NO的热化学方程式为__________________________________。
(2)在汽车排气系统中安装三元催化转化器,可发生反应:2NO(g)+2CO(g) ![]() 2CO2(g)+N2(g)。在某密闭刚性容器中通入等量的CO和NO,发生上述反应时,c(CO)随温度(T)和时间(t)的变化曲线如图所示。
2CO2(g)+N2(g)。在某密闭刚性容器中通入等量的CO和NO,发生上述反应时,c(CO)随温度(T)和时间(t)的变化曲线如图所示。

①据此判断该反应的正反应为____(填“放热”或“吸热”)反应。
②温度T1时,该反应的平衡常数K=_____;反应速率v=v正-v逆=k正c2(NO)c2(CO)-k逆c2(CO2)c(N2),k正、k逆分别为正、逆反应速率常数,计算a处![]() =________。
=________。
(3)SNCR-SCR脱硝技术是一种新型的除去烟气中氮氧化物的脱硝技术,一般采用氨气或尿素作还原剂,其基本流程如图:

①SNCR-SCR脱硝技术中用NH3作还原剂还原NO的主要反应为4NH3(g)+4NO(g)+O2(g)=4N2(g)+6H2O(g),△H<0,则用尿素[CO(NH2)2]作还原剂还原NO2的化学方程式为____________。
②体系温度直接影响SNCR技术的脱硝效率,如图所示:

SNCR与SCR技术相比,SCR技术的反应温度不能太高,其原因是__________;当体系温度约为925℃时,SNCR脱硝效率最高,其可能的原因是______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】200℃、101kPa时,在密闭容器中充入1molH2和1molI2,发生反应I2(g)+H2(g)![]() 2HI(g) ΔH=-14.9 kJ/mol。反应一段时间后,能说明反应已经达到化学平衡状态的是
2HI(g) ΔH=-14.9 kJ/mol。反应一段时间后,能说明反应已经达到化学平衡状态的是
A. 放出的热量小于14.9 kJ
B. 反应容器内压强不再变化
C. HI生成的速率与HI分解的速率相等
D. 单位时间内消耗a mol H2,同时生成2a mol HI
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】分析下图所示的四个原电池装置,其中结论正确的是
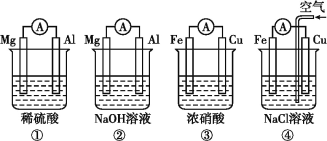
A. ①②中Mg作负极,③④中Fe作负极
B. ②中Mg作正极,电极反应式为6H2O+6e6OH+3H2↑
C. ③中Fe作负极,电极反应式为Fe3eFe3+
D. ④中Cu作正极,电极反应式为2H++2eH2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(本草纲目》记载了民间酿酒的工艺:“凡酸坏之酒,皆可蒸烧”,“以烧酒复烧二次……” 在实验室中模拟上述过程,用到的仪器是
A. 球形冷凝管 B. 蒸发皿 C. 蒸馏烧瓶 D. 分液漏斗
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)室温下,使用pH计测定0.1 mol/LNH4Cl溶液的pH=5.12。由此可以得到的结论是_______(填字母)。
a.溶液中c(H+)>c(OH-)
b.NH4+水解是微弱的
c.NH3·H2O是弱碱
d.由H2O电离出的c(H+)<10-7 mol/L
e.物质的量浓度相等的氨水和盐酸等体积混合,溶液pH=7
(2)室温下,用0.1 mol/LNaOH溶液分别滴定20.00 mL 0.1 mol/L的盐酸和醋酸,滴定曲线如图所示,下列说法正确的是

①表示滴定盐酸的曲线是_______(填序号)。
②滴定醋酸溶液的过程中:
ⅰ.V(NaOH)=10.00 mL时,溶液中离子浓度由大到小的顺序为_________。
ⅱ.当c(Na+)=c(CH3COO—)+c(CH3COOH)时,溶液pH____7(填“>”、“=”或“<”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(双选)对图示两种化合物的结构或性质描述正确的是( )
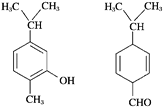
A. 均能与溴水反应
B. 分子中肯定共平面的碳原子数相同
C. 属于同分异构体
D. 可以用红外光谱区分,但不能用核磁共振氢谱区分
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是恒温下H2(g)+I2(g)![]() 2HI(g)+Q(Q>0)的化学反应速率随反应时间变化的示意图,t1时刻改变的外界条件是
2HI(g)+Q(Q>0)的化学反应速率随反应时间变化的示意图,t1时刻改变的外界条件是
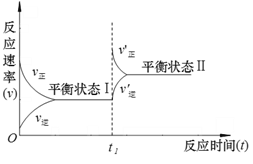
A. 升高温度
B. 增大压强
C. 增大反应物浓度
D. 加入催化剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列叙述不正确的是( )
A. 0.5mol3216S含中子数为8NA
B. 常温下,1 mol NH4Cl含共价键数目为5NA
C. 足量的Cu与含溶质1mol的浓H2SO4反应,转移的电子数小于NA
D. 标准状态下, 11.2LH2和O2的混合气体中分子数目为0.5NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com