
【题目】(1)室温下,使用pH计测定0.1 mol/LNH4Cl溶液的pH=5.12。由此可以得到的结论是_______(填字母)。
a.溶液中c(H+)>c(OH-)
b.NH4+水解是微弱的
c.NH3·H2O是弱碱
d.由H2O电离出的c(H+)<10-7 mol/L
e.物质的量浓度相等的氨水和盐酸等体积混合,溶液pH=7
(2)室温下,用0.1 mol/LNaOH溶液分别滴定20.00 mL 0.1 mol/L的盐酸和醋酸,滴定曲线如图所示,下列说法正确的是

①表示滴定盐酸的曲线是_______(填序号)。
②滴定醋酸溶液的过程中:
ⅰ.V(NaOH)=10.00 mL时,溶液中离子浓度由大到小的顺序为_________。
ⅱ.当c(Na+)=c(CH3COO—)+c(CH3COOH)时,溶液pH____7(填“>”、“=”或“<”)。
【答案】abcⅡc(CH3COO-)>c(Na+)>c(H+)>c(OH-)>
【解析】
(1)室温下,使用pH计测定0.1mol/LNH4Cl溶液的pH=5.12,即溶液显酸性,说明NH4Cl为强酸弱碱盐,即NH3H2O为弱碱。则
a、溶液pH=5.12,即溶液显酸性,故溶液中c(H+)>c(OH-),a正确;
b、NH3H2O为弱碱,故NH4+是弱碱阳离子,在水溶液中能水解,但一般的水解程度很微弱,b正确;
c、溶液显酸性,说明NH4Cl为强酸弱碱盐,即NH3H2O为弱碱,c正确;
d、NH4Cl为强酸弱碱盐,在水溶液中能水解,而盐的水解能促进水的电离,故此溶液中由H2O电离出的c(H+)>10-7mol/L,d错误;
e、物质的量浓度相等的氨水和盐酸等体积混合,恰好完全反应得NH4Cl溶液,但由于NH4Cl为强酸弱碱盐,水解显酸性,故溶液的pH<7,e错误;
答案选abc;
(2)①醋酸是弱电解质,HCl是强电解质,相同浓度的醋酸和HCl溶液,醋酸的pH>盐酸的pH,所以I是滴定醋酸的曲线,Ⅱ表示的是滴定盐酸的曲线;
②i、V(NaOH)=10.00mL时,因此溶液中的溶质为等物质的量浓度的CH3COOH、CH3COONa,醋酸电离程度大于醋酸根离子水解程度,溶液呈酸性,则c(H+)>c(OH-),根据电荷守恒得c(Na+)<c(CH3COO—),故离子浓度的关系为c(CH3COO—)>c(Na+)>c(H+)>c(OH-);
ii、当c(Na+)=c(CH3COO—)+c(CH3COOH),根据物料守恒可知,加入的NaOH溶液的物质的量与醋酸的物质的量相同,此时两者恰好完全反应得醋酸钠溶液,而醋酸钠为强碱弱酸盐,水解显碱性,故溶液的pH>7。


科目:高中化学 来源: 题型:
【题目】下列用来解释实验事实的相关平衡方程式不正确的是
实验事实 | 相关平衡 | |
A | 加入NaHCO3使氯水的漂白能力增强 | Cl2+H2O |
B | 配制FeCl3溶液时加少量盐酸 | Fe3++3OH- |
C | 溶有CO2的正常雨水pH≈5.6 | H2O+CO2 |
D | CaCO3固体溶于盐酸 | CaCO3(s) |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硒(Se)是人体健康必需的一种微量元素。已知Se的原子结构示意图为: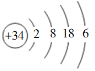 。下列说法不正确的是
。下列说法不正确的是
A. 该原子的质量数为34B. 该元素处于第四周期第ⅥA族
C. SeO2既有氧化性又有还原性D. 酸性:HBrO4 > H2SeO4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】
金属铁及其化合物在材料、航空工业上有重要用途。回答下列相关问题:
(1)基态钛原子中有__________个状态不同的电子,最高能层电子的电子云轮廓图形状为__________,写出其价电子的轨道表达式__________。
(2)化合物TiO2不仅是常用的白色颜料,也是一些反应的良好催化剂,如:

有机物X中C原子的杂化轨道类型为__________,1mol Y中所含σ键的数目是__________。
(3)已知TiCl4在常温下是无色液体,TiCl4的晶体类型是__________晶体,其空间构型是__________。
(4)自然界中有丰富的钛矿资源,如右图表示的是钡钛矿晶体的晶胞结构,经X射线分析,该晶胞为正方体,晶胞参数为apm。
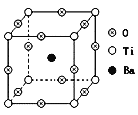
写出钡钛矿晶体的化学式__________,其密度是__________g·cm-3。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业制备合成氨原料气过程中存在反应: CO(g)+H2O(g) ![]() CO2(g)+ H2(g)+ 41.0kJ,下列判断正确的是( )
CO2(g)+ H2(g)+ 41.0kJ,下列判断正确的是( )
A. 该反应的正反应是吸热反应
B. 反应物总能量小于生成物总能量
C. 反应中生成1 mol H2(g)放出41.0kJ热量
D. 反应中消耗1体积CO(g)放出41.0kJ热量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列情况中,会对人体健康造成较大危害的是 ( )
A.用SO2漂白食品B.用小苏打发酵面团制作馒头
C.用食醋清洗热水瓶胆内壁附着的水垢D.用ClO2对自来水进行杀菌消毒。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铝氢化钠(NaAlH4) 是有机合成的重要还原剂。以铝土矿(主要成分为Al2O3,含SiO2和Fe2O3等杂质) 为原料制备铝氢化钠的一种工艺流程如下:
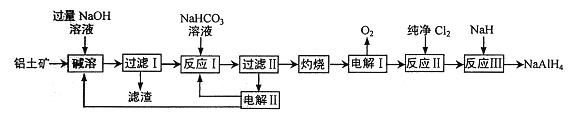
注: SiO2在“碱溶”时转化为铝硅酸钠(Na2Al2SixO8) 沉淀。
(1)铝硅酸钠(Na2Al2SixO8) 可以用氧化物的形式表示其组成,形式为________。
(2) “过滤I”中滤渣主要成分有________(写名称)。向“过滤I”所得滤液中加入NaHCO3溶液,反应的离子方程式为_______________、______________。
(3) “电解I”的另一产物在1000℃时可与N2反应制备AlN,在这种产物中添加少量NH4Cl固体并充分混合,有利于AlN 的制备,其主要原因是__________________。
(4)“电解II”是电解Na2CO3溶液,原理如图所示。
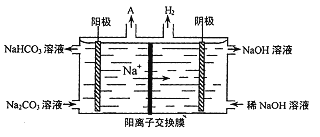
阳极的电极反应式为_________________。
(5)铝氢化钠遇水发生剧烈反应产生大量气泡,其反应的化学方程式为_____________,每产生1mol 气体转移电子数为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钮扣电池的电极材料为Zn和Ag2O,电解质溶液为KOH,其电极反应为:Zn + 2OH--2e-=ZnO+ H2O 、Ag2O + H2O + 2e-=2Ag+ 2OH-,电池的负极是_____(填电极材料),正极发生的是_____反应(填反应类型),总反应式为______________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com