
【题目】铝氢化钠(NaAlH4) 是有机合成的重要还原剂。以铝土矿(主要成分为Al2O3,含SiO2和Fe2O3等杂质) 为原料制备铝氢化钠的一种工艺流程如下:
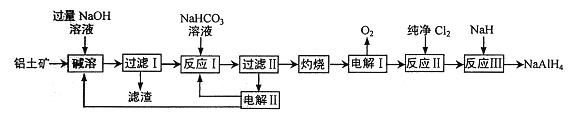
注: SiO2在“碱溶”时转化为铝硅酸钠(Na2Al2SixO8) 沉淀。
(1)铝硅酸钠(Na2Al2SixO8) 可以用氧化物的形式表示其组成,形式为________。
(2) “过滤I”中滤渣主要成分有________(写名称)。向“过滤I”所得滤液中加入NaHCO3溶液,反应的离子方程式为_______________、______________。
(3) “电解I”的另一产物在1000℃时可与N2反应制备AlN,在这种产物中添加少量NH4Cl固体并充分混合,有利于AlN 的制备,其主要原因是__________________。
(4)“电解II”是电解Na2CO3溶液,原理如图所示。
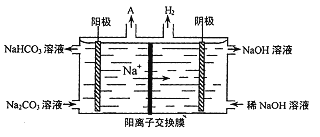
阳极的电极反应式为_________________。
(5)铝氢化钠遇水发生剧烈反应产生大量气泡,其反应的化学方程式为_____________,每产生1mol 气体转移电子数为______。
【答案】Na2O·Al2O3·2SiO2 铝硅酸钠、氧化铁 OH-+HCO3-=CO32-+H2O AlO2-+HCO3-+H2O=CO32-+Al(OH)3↓ 氯化铵分解产生的氯化氢能够破坏铝表面的氧化铝薄膜 4CO32-+2H2O-4e-=4HCO3-+O2↑ NaAlH4+2H2O=NaAlO2+4H2↑ NA
【解析】
以铝土矿(主要成分为Al2O3,含SiO2和Fe2O3等杂质)为原料制备铝,由流程可知,加NaOH溶解时Fe2O3不反应,由信息可知SiO2在“碱溶”时转化为铝硅酸钠沉淀,过滤得到的滤渣为Fe2O3、铝硅酸钠,碳酸氢钠与偏铝酸钠反应生成Al(OH)3,过滤II得到Al(OH)3,灼烧生成氧化铝,电解I为电解氧化铝生成Al和氧气,电解II为电解Na2CO3溶液,结合图可知,阳极上碳酸根离子失去电子生成碳酸氢根离子和氧气,阴极上氢离子得到电子生成氢气。
(1)铝硅酸钠(Na2Al2SixO8)可以用氧化物的形式表示为Na2O·Al2O3·2SiO2,故答案为:Na2O·Al2O3·2SiO2;
(2) 根据上述分析,“过滤I”中滤渣主要有铝硅酸钠、氧化铁。向“过滤I”所得滤液中加入NaHCO3溶液,碳酸氢钠与偏铝酸钠和过量的氢氧化钠反应,反应的离子方程式为OH-+HCO3-=CO32-+H2O、AlO2-+HCO3-+H2O=CO32-+Al(OH)3↓,故答案为:铝硅酸钠、氧化铁;OH-+HCO3-=CO32-+H2O;AlO2-+HCO3-+H2O=CO32-+Al(OH)3↓;
(3)铝粉在1000℃时可与N2反应制备AlN,在铝粉中添加少量NH4Cl固体并充分混合,有利于AlN的制备,其主要原因是NH4Cl分解产生的HCl能够破坏Al表面的Al2O3薄膜,使铝更容易与氮气反应,故答案为:NH4Cl分解产生的HCl能够破坏Al表面的Al2O3薄膜;
(4)由图可知,阳极反应为4CO32-+2H2O-4e-═4HCO3-+O2↑,阴极上氢离子得到电子生成氢气,故答案为:4CO32-+2H2O-4e-═4HCO3-+O2↑;
(5)铝氢化钠(NaAlH4)遇水发生剧烈反应产生大量气泡,反应生成偏铝酸钠和氢气,反应的化学方程式为NaAlH4+2H2O=NaAlO2+4H2↑,根据方程式,NaAlH4中H由-1价变成0价,H2O中H由+1价变成0价,每产生1mol氢气转移电子1mol,故答案为:NaAlH4+2H2O=NaAlO2+4H2↑;NA。


科目:高中化学 来源: 题型:
【题目】为探究碳酸氢钠的热稳定性,并利用其产物验证过氧化钠与二氧化碳的反应,按以下装置图进行实验,按要求填空。

(1)A中反应的化学方程式为________。
(2)B中浓硫酸的作用是____。
(3)C中发生反应的化学方程式为____,每反应1molNa2O2转移______mol电子。
(4)D中现象是_____,反应的离子方程式是_____________________。
(5)E中收集的气体主要是________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)室温下,使用pH计测定0.1 mol/LNH4Cl溶液的pH=5.12。由此可以得到的结论是_______(填字母)。
a.溶液中c(H+)>c(OH-)
b.NH4+水解是微弱的
c.NH3·H2O是弱碱
d.由H2O电离出的c(H+)<10-7 mol/L
e.物质的量浓度相等的氨水和盐酸等体积混合,溶液pH=7
(2)室温下,用0.1 mol/LNaOH溶液分别滴定20.00 mL 0.1 mol/L的盐酸和醋酸,滴定曲线如图所示,下列说法正确的是

①表示滴定盐酸的曲线是_______(填序号)。
②滴定醋酸溶液的过程中:
ⅰ.V(NaOH)=10.00 mL时,溶液中离子浓度由大到小的顺序为_________。
ⅱ.当c(Na+)=c(CH3COO—)+c(CH3COOH)时,溶液pH____7(填“>”、“=”或“<”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素X、Y、Z、W、Q在元素周期表中的相对位置如图所示。
X | Y | ||||
Z | W | Q | |||
(1)Q的原子结构示意图是________。
(2)Y、Z、W形成简单离子,其离子半径关系为________(用离子符号表示)。
(3)用有关离子方程式表示Q、W元素的非金属性强弱______________
(4)Y的氢化物分子中含有18个电子,该分子中的共价键类型_____________________________。
(5)W的最高价氧化物对应的水化物的浓溶液与Cu反应的化学方程式为________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是恒温下H2(g)+I2(g)![]() 2HI(g)+Q(Q>0)的化学反应速率随反应时间变化的示意图,t1时刻改变的外界条件是
2HI(g)+Q(Q>0)的化学反应速率随反应时间变化的示意图,t1时刻改变的外界条件是
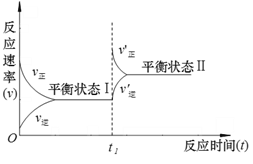
A. 升高温度
B. 增大压强
C. 增大反应物浓度
D. 加入催化剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列图示与对应的叙述相符的是( )
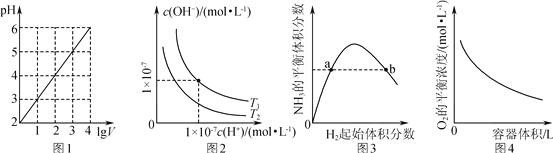
A. 图1表示1 L pH=2的CH3COOH溶液加水稀释至V L,pH随lg V的变化
B. 图2表示不同温度下水溶液中H+和OH-浓度的变化的曲线,图中温度T2>T1
C. 图3表示一定条件下的合成氨反应中,NH3的平衡体积分数随H2起始体积分数(N2的起始量恒定)的变化,图中a点N2的转化率小于b点
D. 图4表示同一温度下,在不同容积的容器中进行反应2BaO2(s) ![]() 2BaO(s)+O2(g),O2的平衡浓度与容器容积的关系
2BaO(s)+O2(g),O2的平衡浓度与容器容积的关系
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以丙烯为原料合成抗炎药物D和机体免疫增强制剂Ⅰ的合成路线如下(部分反应条件和产物己经略去):
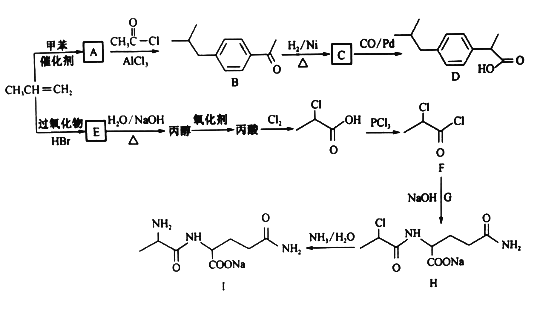
回答下列问题:
(1)由丙烯生成A的反应类型为________,由H生成I的反应类型为______________。
(2)E的结构简式为_____________,F中含氧官能团的名称为___________________。
(3)化合物G的化学式为C5H10O3N2,则其结构简式为___________________。
(4)A→B反应的化学方程式为 ________。
(5)A的同分异构体中属于苯的同系物的共有________种(不包含A),其中核磁共振氢谱有四组峰的
是________ (写一种结构简式)。
(6)已知: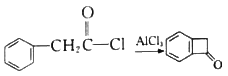 。结合上述流程中的信息,设计由制备
。结合上述流程中的信息,设计由制备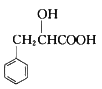 制备
制备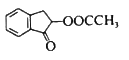 的合成路线:_______________________。
的合成路线:_______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向含4mol KNO3和2.5mol H2SO4的某稀溶液中加入1.5mol铁,充分反应后,产生的气体在标准状况下的体积为( )
A. 33.6LB. 28LC. 22.4LD. 11.2L
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com