
����Ŀ��ʵ������Ҫ0.1 mol/L NaOH��Һ450 mL��0.5 mol/L H2SO4��Һ450 mL��������������Һ����������ش��������⣺

��1����ͼ��ʾ��������������Һ�϶�����Ҫ����______(�����)������C��������________����ʵ�����貣������E�Ĺ���������________��
��2�����в����У�����ƿ�����߱��Ĺ�����________(�����)
A������һ�����ȷŨ�ȵı���Һ B������������Һ
C�����������ܽ�������� D����ȡ220 mL��Һ
��3��������NaOH��Һ��ʵ���У�������������ȷ��������ʱ���ӿ̶��ߣ�����������Һ��Ũ�Ƚ�________0.1 mol/L(����������������������С��������ͬ)����NaOH��Һδ��ȴ��ת��������ƿ���ݣ�����������ҺŨ�Ƚ�________0.1 mol/L��
��4�����ݼ����֪��������������Ϊ98%���ܶ�Ϊ1.84 g/cm3��Ũ��������Ϊ________mL(����������һλС��)�����ʵ������10 mL��25 mL��50 mL������Ͳ��Ӧѡ��________mL����á�
��5�����������ȷ�IJ�����_________________________��
��6��������Ҫ������������ȷ�ķ��÷�ʽ_________________________
���𰸡�AC ��Һ©�� 500 mL����ƿ BCD С�� ���� 13.6 25 �ý�ͷ�ιܵμӣ��۾�ƽ�ӿ̶��ߣ�����Һ����ʹ��պ���̶�������ʱֹͣ�μ� ��б�����治�ܽӴ�����ƿ�ڱڣ��¶��ڿ̶������¡�
��������
��1����������һ�����ʵ���Ũ����Һ��һ�㲽��ѡ����Ҫ������ȷ���ò�����������ȱ�ٵ�������
��2����������ƿʹ�÷�����ע��������
��3������![]() ��������жϣ�
��������жϣ�
��4��������Һ���ѡ��500 mL������ƿ������ϡ��ǰ�����������������Ũ�������������ݡ����������ԭ��ѡ����Ͳ��
��5��������ȷ�Ķ��ݲ����ش�
��6����������������ע������ش�
��1������һ�����ʵ���Ũ����Һ��һ�㲽�裺���㡢����������ȡ���ܽ����ϡ�͡���Һ��ϴ�ӡ����ݡ�ҡ�ȣ��õ���������������ƽ��ҩ�ס���Ͳ���ձ�����������500mL����ƿ����ͷ�ιܣ��ò���ƽ����ƿ�ͷ�Һ©����ѡAC������C�������Ƿ�Һ©��������450 mL��Һ������500 mL����ƿ��
��2��A������һ�����ȷŨ�ȵı���Һ������������ƿ���ʲ�ѡA�� B������ƿ����������Һʱ�Ķ��ݣ����ܳ���������Һ����ѡB�� C������ƿ����������Һʱ�Ķ��ݣ��������������ܽ�������ʣ���ѡC�� D������ƿ����������Һʱ�Ķ��ݣ�����������ȡ220 mL��Һ����ѡD��
��3��������NaOH��Һ��ʵ���У�������ʱ���ӿ̶��ߣ�������Һ���ƫ������������Һ��Ũ�Ƚ�С��0.1 mol/L����NaOH��Һδ��ȴ��ת��������ƿ���ݣ�������Һ���ƫС������������ҺŨ�Ƚ�����0.1 mol/L��
��4��������Һ���ѡ��500 mL������ƿ��ϡ��ǰ�������������䣬����Ũ����������VmL����0.5 mol/L��0.5L��98g/mol= VmL��1.84 g/cm3��98%��V=13.6 mL�����������������ԭ��ѡ��25 mL��Ͳ��ȡŨ������ã�
��5����ȷ�Ķ��ݲ�������Һ����̶���1![]() 2cmʱ�����ý�ͷ�ιܵμӣ��۾�ƽ�ӿ̶��ߣ�����Һ����ʹ��պ���̶�������ʱֹͣ�μӣ�
2cmʱ�����ý�ͷ�ιܵμӣ��۾�ƽ�ӿ̶��ߣ�����Һ����ʹ��պ���̶�������ʱֹͣ�μӣ�
��6���ò���������ʱ��������Ҫ��б�����治�ܽӴ�����ƿ�ڱڣ��¶��ڿ̶������¡�


 ����ͼ���������������ϵ�д�
����ͼ���������������ϵ�д� ����ѧҵ���Ե�����ϵ�д�
����ѧҵ���Ե�����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����һ�ݻ��ɱ���ܱ������м���WO3��H2���з�Ӧ��WO3(s)+3H2(g)![]() W(s)+3H2O(g)������˵������ȷ���ǣ� ��
W(s)+3H2O(g)������˵������ȷ���ǣ� ��
A.�������������Сһ�룬�䷴Ӧ��������
B.����������䣬����������䷴Ӧ���ʲ���
C.����ѹǿ���䣬����������H2O(g)��������������
D.����ѹǿ���䣬����������H2O(g)��H2(g)���������ʼ�С
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������(��ҪΪNO��NO2)�Ǵ�����Ⱦ������Ч�����������������Ⱦ��Ŀǰ��ѧ�����о����ȵ����⡣
��1��������[CO(NH2)2]���յ���������һ�ֿ��еķ�����
�������ڸ�����������NO2��Ӧת���������壬�÷�Ӧ�Ļ�ѧ����ʽΪ___����������ҺҲ�����յ�������о������������������![]() =1ʱ���ܵ���ԭ����ߣ����ţ�
=1ʱ���ܵ���ԭ����ߣ����ţ�![]() ��ֵ�����ܵ���ԭ�ʽ��͵���Ҫԭ����___��
��ֵ�����ܵ���ԭ�ʽ��͵���Ҫԭ����___��
����һ�����Ϊ1L�ĺ����ܱ������г���1molCO2��1molNH3���ں㶨�¶���ʹ�䷢����Ӧ2NH3(g)+CO2(g)![]() NH2CONH2(s)+H2O(g) ��H��0���ﵽƽ�⣬��������а��������������ʱ��ı仯��ͼ��ʾ��
NH2CONH2(s)+H2O(g) ��H��0���ﵽƽ�⣬��������а��������������ʱ��ı仯��ͼ��ʾ��

��A��ʱv��(CO2)___(������������������=��)B��ʱv��(CO2)��ԭ����___��B��ʱ��NH3��ת����Ϊ___��
�������йط�Ӧ2NH3(g)+CO2(g)![]() CO��NH2)2(s)+H2O(g)��˵����ȷ����___��
CO��NH2)2(s)+H2O(g)��˵����ȷ����___��
A.��������������أ�NH3��ת���ʽ�����
B.��Ӧ�ﵽƽ��ʱ�����ͷ�Ӧ��ϵ���¶ȣ�CO2��Ũ�ȼ�С
C.NH3��ת����ʼ�յ���CO2��ת����
D.������Ч�Ĵ����ܹ�������صIJ���
��2����֪O3���������������Ҫ��Ӧ���Ȼ�ѧ����ʽ���£�
2NO(g)+O2(g)=2NO2(g) ��H1=akJ��mol-1
NO(g)+O3(g)=NO2(g)+O2(g) ��H2=bkJ��mol-1
6NO2(g)+O3(g)=3N2O5(g) ��H3=ckJ��mol-1
��Ӧ4NO2(g)+O2(g)=2N2O5(g)��H=___(�ú�a��b��c�Ĵ���ʽ��ʾ)kJ��mol-1��
��3����������Ҳ���ü�Һ���ա���NO��NO2�Ļ�����屻NaOH��Һ��ȫ���գ�ֻ����һ���Σ�����εĻ�ѧʽΪ___����֪������Ka(HNO2)=5��10-4����ӦHNO2(aq)+NaOH(aq)![]() NaNO2(aq)+H2O(l)��ƽ�ⳣ��K=___��
NaNO2(aq)+H2O(l)��ƽ�ⳣ��K=___��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������β����CO��![]() ��һ�������¿ɷ�����Ӧ
��һ�������¿ɷ�����Ӧ![]() ��һ���¶��£����ݻ��̶���2L���ܱ������г���һ������CO��
��һ���¶��£����ݻ��̶���2L���ܱ������г���һ������CO��![]() ��
��![]() �����ʵ�����ʱ��ı仯������ͼ��ʾ��
�����ʵ�����ʱ��ı仯������ͼ��ʾ��

��1��0��10min�ڸ÷�Ӧ��ƽ����Ӧ����![]() ________
________
��2�����º��������£�����˵���÷�Ӧ�Ѿ��ﵽƽ��״̬����________������ţ�
A.�����ڻ��������ɫ���ٱ仯
B.�����ڵ�ѹǿ���ֲ���
C.�����ڻ�������ܶȱ��ֲ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ó���������ˮ��ϴ���ú����ֺ���ɫ����ߣ�ijͬѧ������ԭ�����������з�������ͬѧ��������ʵ����Ʒ��20%��NaCl��Һ������ˮ����̪��Һ��KSCN��Һ��������ˮ������˿��̼����U�ιܡ����ߵȣ������һ��ʵ�鷽����֤������ʴ�ĵ缫��������������̲�д����Һ���йط�Ӧ�����ӷ���ʽ��________
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������İ�������һ����Ҫ�����ǣ���������˶�Ա�����˷ܼ���ij���˷ܼ��Ľṹ��ʽ��ͼ��ʾ���йظ����ʵ�˵����ȷ���ǣ� ��
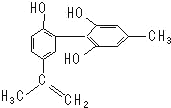
A.��FeCl3��Һ����ɫ����Ϊ�������뱽������ͬϵ��
B.����KMnO4��H+����Һ���۲���ɫ��ȥ����֤���ṹ�д���̼̼˫��
C.1mol��������Ũ��ˮ��H2��Ӧ�������Br2��H2�ֱ�Ϊ4mol��7mol
D.�÷����е�����ԭ�ӿ��ܹ�ƽ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���α������һ������Ѫ�����ŵĽ�Ѫѹҩ����ںϳ��α�����м���G�IJ���������ͼ��

��֪���������Ľṹ��ʽΪ![]()
��ش��������⣺
��1��G�����еĺ��������ŵ�������___��___��
��2����ӦA��B�Ļ�ѧ����ʽΪ___��
��3�������ܡ��ݱ仯���̵ķ�Ӧ���ͷֱ���___��___��
��4��д����������������C��һ��ͬ���칹��Ľṹ��ʽ��___��
��.������ֻ������ȡ����
��.������ֻ��4�ֲ�ͬ��ѧ��������
��.����NaHCO3��Ӧ����CO2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ҹ���ѧ����ƵĶ�����̼�����β��绯ѧת��װ����ͼ��ʾ������˵����ȷ���ǣ� ��
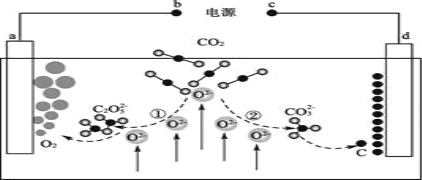
A.a���ǵ绯ѧװ�õ�����
B.d���ĵ缫��ӦʽΪCO32- - 4e- = C + 3O2-
C.���У�����CO2ʱ̼Ԫ�صĻ��ϼ۷����˱仯
D.����װ���з�Ӧ�Ļ�ѧ����ʽΪCO2 ![]() C + O2��
C + O2��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������£���20.00 mL 0.100 0 molL��1 (NH4)2SO4��Һ����μ���0.200 0 molL��1 NaOH��Һʱ����Һ��pH������NaOH��Һ����Ĺ�ϵ��ͼ��ʾ(�����ǻӷ�)������˵����ȷ����
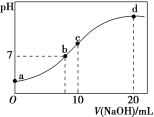
A. ��a��ʾ��Һ�У�c(NH4+)��c(SO42-)��c(OH��)��c(H��)
B. ��b��ʾ��Һ�У�c(NH4+)��c(Na��)��c(H��)��c(OH��)
C. ��c��ʾ��Һ�У�c(SO42-)��c(H��)��c(NH3��H2O)��c(OH��)
D. ��d��ʾ��Һ�У�c(SO42-)��c(NH3��H2O)��c(OH��)��c(NH4+)
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com