
【题目】下列有关元素性质的递变规律不正确的是
A. Na、Mg、Al的金属性依次减弱 B. H2S、H2O、HF的稳定性依次减弱
C. Cl-、Br-、I-还原性依次增强 D. Na、K、Rb的原子半径依次增大
 课时训练江苏人民出版社系列答案
课时训练江苏人民出版社系列答案 黄冈经典趣味课堂系列答案
黄冈经典趣味课堂系列答案 启东小题作业本系列答案
启东小题作业本系列答案科目:高中化学 来源: 题型:
【题目】化学与生活密切相关,下列说法正确的是
A. SO2可用于杀菌、消毒
B. 汽车尾气中含有大量大气污染物,这是汽油不完全燃烧造成的
C. 碘是人体必需微量元素,所以要多吃富含髙碘酸的食物
D. 海水淡化的方法主要有蒸馏法、电解法、离子交换法等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碱性锌锰电池的反应方程式为: 2MnO2+Zn+2H2O=2MnOOH+Zn(OH)2,其构造如图所示。有
关说法不正确的是

A. 负极反应式:Zn+2OH--2e-=Zn(OH)2
B. 放电时正极MnO2得到电子,发生氧化反应
C. 该电池使用一段时间后,电解液pH增大
D. 放电时,锌粉失去的电子,从负极通过外电路流向正极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NiSO4易溶于水,其水溶液呈酸性,有毒。主要用于电镀工业,也是金属镍离子的来源。NiSO4·6H2O是一种绿色易溶于水的晶体,可由电镀废渣(除镍外,还含有铜、锌、铁等元素)为原料获得.操作步骤如下:

(1)NiSO4水溶液呈酸性原因是_________________________;
(2)向滤液Ⅱ中加入H2O2的离子方程式:_________________________;
(3)调滤液ⅡpH的目的是除去Fe3+,原理是Fe3++3H2O![]() Fe(OH)3+3H+,已知25℃时Ksp[Fe(OH)3]=2.8×10﹣39,则该温度下上述反应的平衡常数K=______,设计实验证明Fe3+已除净_________________;
Fe(OH)3+3H+,已知25℃时Ksp[Fe(OH)3]=2.8×10﹣39,则该温度下上述反应的平衡常数K=______,设计实验证明Fe3+已除净_________________;
(4)滤液Ⅲ溶质的主要成分是NiSO4,加Na2CO3过滤后得到NiCO3固体,再加适量稀硫酸溶解又生成NiSO4,这两步操作的目的是______;
(5)从d(NiSO4溶液)经______、______、______洗涤、干燥等操作可得到NiSO4·6H2O晶体;
(6)为了提高产率,分离得到NiSO4·6H2O后剩余液体要循环使用,则应该回流到流程中的______位置(填a、b、c、d)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求完成下列填空:
(1)1 mol NaHSO4溶于水能电离出___________________个SO42-。
(2)1.7![]()
![]() 含
含![]() 原子物质的量为_____________,质子数为______,已知
原子物质的量为_____________,质子数为______,已知![]()
![]() 含原子数为
含原子数为![]() ,则阿伏伽德罗常数为______(用含
,则阿伏伽德罗常数为______(用含![]() 、
、![]() 的代数式表示)。
的代数式表示)。
(3)标况下,等质量的氧气与臭氧的体积之比为 __________________,氧原子个数之比 _______________。
(4)某金属氯化物MClx的摩尔质量为133.5g/mol,取该金属氯化物26.7g配成水溶液,与足量AgNO3溶液完全反应,生成86.1g白色沉淀。则金属M的摩尔质量为 _______________________。
(5)标准状况下,密度为0.75g/L的NH3与CH4组成的混合气体中,NH3的体积分数为______,该混合气体对氢气的相对密度为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是
A. 酒越陈越香与酯化反应有关
B. 乙烷、丙烷和丁烷都没有同分异构体
C. 乙烯和聚乙烯都能使溴的四氯化碳溶液褪色
D. 甲烷与足量氯气在光照下反应可生成难溶于水的油状液体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】a、b、c、d是四种常见的短周期主族元素,其原子半径随原子序数的变化如下图所示。已知b、c两种元素的单质是空气的主要成分,d原子的最外层电子数与Ne原子的最外层电子数相差2。下列说法正确的是
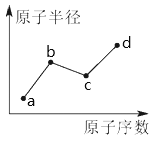
A. b、c、d处于同一周期
B. 氢化物的稳定性:d>c
C. a、c、d可形成强弱程度不同的含氧酸
D. b、d的最简单氢化物可相互化合形成共价化合物
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com