
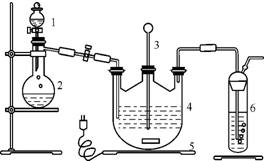
 硫代硫酸钠(Na2S2O3)可由亚硫酸钠和硫粉通过化合反应制得:Na2SO3+S
硫代硫酸钠(Na2S2O3)可由亚硫酸钠和硫粉通过化合反应制得:Na2SO3+S
| ||
| 5 |
| 8 |
| 248g/mol×0.005mol |
| 1.28g |


 期末冲刺100分创新金卷完全试卷系列答案
期末冲刺100分创新金卷完全试卷系列答案科目:高中化学 来源: 题型:
| A、H+、Ba2+、Fe3+、NO3-,通入SO2气体 |
| B、Ca2+、Cl-、K+、H+,通入CO2气体 |
| C、AlO2-、Na+、Br-、SO42-,通入CO2气体 |
| D、HCO3-、Na+、I-、HS-,加入AlCl3溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
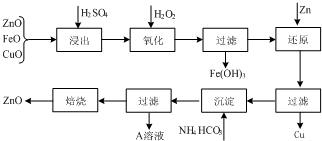
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、O2和O3的混合气体共6.4g,其中所含氧原子数一定为0.4NA |
| B、常温常压下,22.4L二氧化碳含有的原子总数为3NA |
| C、将标准状况下22.4L NO与11.2L O2混合后所含分子数为1.5NA |
| D、物质的量浓度为0.25mol?L-1的MgCl2溶液中含有Cl个数为0.5NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
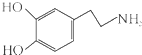 多巴胺是一种神经递质,用来帮助细胞传送脉冲的化学物质.这种脑内分泌物主要负责大脑的情感,将兴奋及开心的信息传递,使人感到愉悦和快乐.多巴胺可由香兰素与硝基甲烷缩合,再经锌还原水解而得,合成过程如下:
多巴胺是一种神经递质,用来帮助细胞传送脉冲的化学物质.这种脑内分泌物主要负责大脑的情感,将兴奋及开心的信息传递,使人感到愉悦和快乐.多巴胺可由香兰素与硝基甲烷缩合,再经锌还原水解而得,合成过程如下: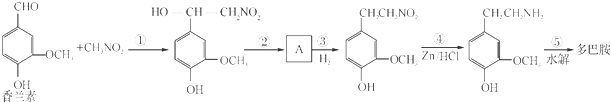
查看答案和解析>>
科目:高中化学 来源: 题型:
| 氨碱法 | 联合制碱法 | ||
| A | 原料 | 食盐、氨气、生石灰 | 食盐、氨气、二氧化碳 |
| B | 可能的副产物 | 氯化钙 | 氯化铵 |
| C | 循环物质 | 氨气、二氧化碳 | 氯化钠 |
| D | 评价 | 原料易得;设备复杂;能耗高 | 原料利用率高;废弃物少 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、联合制碱法生产的两种产品一种是碱,一种是盐 |
| B、在硫酸工业生产过程的接触室中运用热交换技术可充分利用能源 |
| C、在合成氨生产中有原料循环使用的工艺,可以提高原料的利用率 |
| D、用烧碱溶液吸收精制硝酸产生的尾气中的氮氧化物符合绿色化学理念 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、石油裂解、煤的气化、海水制镁都包含化学变化来源 |
| B、福尔马林可制备标本是利用了使蛋白质变性的性质 |
| C、含钙、钡、铂等金属元素的物质有绚丽的颜色,可用于制造焰火 |
| D、红葡萄酒储藏时间长后变香可能是因为乙醇发生了酯化反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、该有机物的相对分子质量为28 |
| B、分子中C、H个数比为1:2 |
| C、分子中的C、H、O个数比为1:2:3 |
| D、该分子中肯定不含氧元素 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com