
| A、联合制碱法生产的两种产品一种是碱,一种是盐 |
| B、在硫酸工业生产过程的接触室中运用热交换技术可充分利用能源 |
| C、在合成氨生产中有原料循环使用的工艺,可以提高原料的利用率 |
| D、用烧碱溶液吸收精制硝酸产生的尾气中的氮氧化物符合绿色化学理念 |
| ||


 同步练习强化拓展系列答案
同步练习强化拓展系列答案科目:高中化学 来源: 题型:


查看答案和解析>>
科目:高中化学 来源: 题型:
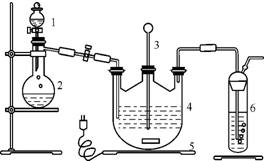 硫代硫酸钠(Na2S2O3)可由亚硫酸钠和硫粉通过化合反应制得:Na2SO3+S
硫代硫酸钠(Na2S2O3)可由亚硫酸钠和硫粉通过化合反应制得:Na2SO3+S
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
| 50ml盐酸 | 50ml盐酸 | 50ml盐酸 | |
| M(混合物) | 9.2g | 15.7g | 27.6g |
| V(标准状况) | 2.24L | 3.36L | 3.36L |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、4:9 | B、1:1 |
| C、7:6 | D、4:3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
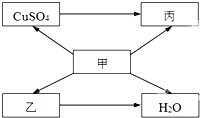 甲、乙、丙为初中化学常见物质,其中乙为胃液中的一种酸.他们相互转化关系如图所示(“→”表示物质变化,部分反应条件和部分生成物已省略).
甲、乙、丙为初中化学常见物质,其中乙为胃液中的一种酸.他们相互转化关系如图所示(“→”表示物质变化,部分反应条件和部分生成物已省略).查看答案和解析>>
科目:高中化学 来源: 题型:
| A、用氢气还原氧化铜时,应先通一会儿氢气,再加热氧化铜 |
| B、给试管里的固体加热时,试管口应略向下倾斜,外壁干燥后再预热 |
| C、给试管里的液体加热时,试管口应略向上倾斜(约45°角),外壁干燥后再预热 |
| D、酒精灯在不使用时,必须盖上灯帽 |
查看答案和解析>>
科目:高中化学 来源: 题型:
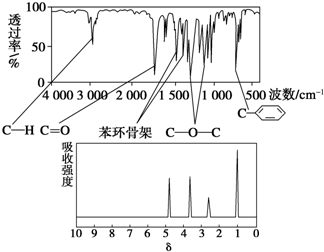
| A、与A属于同类化合物的同分异构体只有2种 |
| B、A在一定条件下可与4 mol H2发生加成反应 |
| C、A分子属于酯类化合物,在一定条件下不能发生水解反应 |
| D、符合题中A分子结构特征的有机物只有1种 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com