
【题目】膳食纤维具有突出的保健功能,称为人体的“第七营养素”。木质素是一种非糖类膳食纤维,其单体之一是芥子醇,结构简式如图所示。下列有关芥子醇的说法正确的是
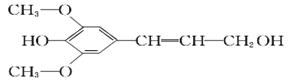
A. 芥子醇的分子式中有一种含氧官能团
B. 芥子醇分子中所有碳原子不可能在同一平面上
C. 芥子醇能与FeCl3溶液发生显色反应,且1mol芥子醇能够与3 mol的Br2水反应
D. 芥子醇能发生的反应类型有氧化、取代、加成
科目:高中化学 来源: 题型:
【题目】同温同压下,等质量的O2和O3相比较,下列结论正确的是
A.它们的分子数目之比是 1∶1 B.它们的氧原子数目之比为 2∶3
C.它们的体积之比是 1∶1 D.它们的密度之比为 2∶3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组离子在水溶液中能够大量共存的是( )
A.Ba2+、Cl-、NO3-、Ca2+ B.H+、Na+、SO42-、CO32-
C.Cu2+、K+、Cl--、OH- D.Ca2+、Na+、CO32、Cl-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.现有①0.2 mol·L-1NaOH溶液和②0.2 mol·L-1HX溶液,两溶液等体积混合后,测得溶液中c(Na+)>c(X-)。则:
(1)①中由水电离出的c(OH-)__________②中由水电离出的c(H+)(填“>”、“=”或“<”)。
(2)上述混合液中共存在__________种粒子。其中:c(HX)+c(X-)__________0.1 mol·L-1(忽略混合前后溶液体积变化;填“>”、“=”或“<”)。请根据电荷守恒写出一个用离子浓度表示的等式:_____________________________________。
(3)上述混合液显__________性(填“酸”、“碱”或“中”),其原因用离子方程式表示为_______________________________________。
Ⅱ.海水中含有大量的元素,常量元素(如氯)、微量元素(如碘)在海水中均以化合态存在。在25 ℃时,向0.1 mol·L-1的NaCl溶液中逐滴加入适量的0.1 mol·L-1硝酸银溶液,有白色沉淀生成,向反应后的浊液中,继续加入0.1 mol·L-1的NaI溶液,看到的现象是___________________________,产生该现象的原因是(用离子方程式表示)__________________。
[已知25 ℃时Ksp(AgCl)=1.0×10-10、Ksp(AgI)=1.5×10-16]
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】天然气、可燃冰、页岩气、沼气的主要成分都是甲烷,甲烷既是一种清洁能源,也是一种重要的化工原料。
(1)以甲烷为主要原料可生产合成气(CO和H2)。
已知:①CH4(g)+2O2(g)===CO2(g)+2H2O(g)
ΔH=-802.3 kJ·mol-1
②CO(g)+H2O(g) ![]() CO2(g)+H2(g)
CO2(g)+H2(g)
ΔH=-41.0 kJ·mol-1
③2CO(g)+O2(g)===2CO2(g)
ΔH=-566.0 kJ·mol-1
则反应CO2(g)+CH4(g) ![]() 2CO(g)+2H2(g)的ΔH=__________________。
2CO(g)+2H2(g)的ΔH=__________________。
(2)以二氧化钛表面覆盖Cu2Al2O4为催化剂,可以将CO2和CH4直接转化成乙酸,反应方程式为CO2(g)+CH4(g) ![]() CH3COOH(g)。
CH3COOH(g)。
①在不同温度下催化剂的催化效率与乙酸的生成速率如图1所示。250~300 ℃时,温度升高而乙酸的生成速率降低的原因是_________________________。
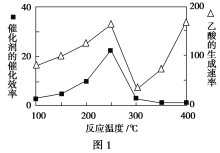
②为了提高该反应中CH4的转化率,可以采取的措施是______________________(写出一条即可)。
(3)甲烷燃料电池是一种新型电池。如图2所示,装置Ⅰ为甲烷燃料电池(电解质溶液为KOH溶液),通过装置Ⅱ可实现铁棒上镀铜。
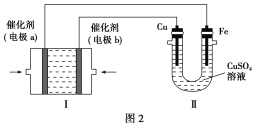
①电极b上的电极反应式是______________________。
②电镀结束后,装置Ⅰ中溶液的pH________(填“变大”、“变小”或“不变”,下同),装置Ⅱ中Cu2+的物质的量浓度______________。
③若完全反应后,装置Ⅱ中阴极质量增加12.8 g,则装置Ⅰ中理论上消耗的氧气在标准状况下的体积为________L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】开发新能源是解决环境污染的重要举措,其中甲醇、甲烷是优质的清洁燃料,可制作燃料电池。
(1)已知:
①2CH3OH(l)+3O2(g)===2CO2(g)+4H2O(g)
ΔH1=-1 274.0 kJ/mol
②2CO(g)+O2(g)===2CO2(g) ΔH2=-566.0 kJ/mol
③H2O(g)===H2O(l) ΔH3=-44 kJ/mol
甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式为___________________________。
(2)生产甲醇的原料CO和H2可由反应CH4(g)+H2O(g) ![]() CO(g)+3H2(g) ΔH>0得到。
CO(g)+3H2(g) ΔH>0得到。
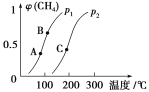
①一定条件下CH4的平衡转化率与温度、压强的关系如图。则p1________p2(填“<”、“>”或“=”)。A、B、C三点处对应平衡常数(KA、KB、KC)的大小顺序为________________。
②100 ℃时,将1 mol CH4和2 mol H2O通入容积为1 L的定容密闭容器中发生反应,能说明该反应已经达到平衡状态的是________(填序号)。
a.容器的压强恒定
b.容器内气体密度恒定
c.3v正(CH4)=v逆(H2)
d.单位时间内消耗0.1 mol CH4同时生成0.3 mol H2
(3)甲醇燃料电池(简称DMFC)由于结构简单、能量转化率高、对环境无污染,可作为常规能源的替代品而越来越受到关注。DMFC工作原理如图所示,通入a气体的电极是原电池的________极(填“正”或“负”),其电极反应式为______________________________。
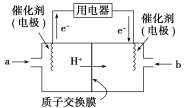
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】七水硫酸镁(MgSO4·7H2O)可用于印染加重剂,制造瓷器、颜料和防火材料。在医药上用作泻剂,在徽生物工业作培养基成分等。可利用化工厂生产硼砂的废渣——硼镁泥制取七水硫酸镁(MgSO4·7H2O),硼镁泥的主要成分是MgCO3,还含有其它杂质(MgO、Na2B4O7、SiO2、Fe2O3、CaO、Al2O3、MnO等)。
硼镁泥制取七水硫酸镁的工艺流程图如下:

表l:部分阳离子开好成淀和完全沉淀时溶液的pH
Fe3+ | Fe2+ | Mn2+ | Mg2+ | Al3+ | |
开始沉淀的pH | 1.9 | 7.9 | 8.6 | 9.6 | 3.1 |
完全沉淀的pH | 3.2 | 9.0 | 10.l | 11 | 5.4 |
据此试回答下列问题:
(1)写出生成H3BO3的离子方程式______________。
(2)NaClO具有强氧化性,能直接将溶液中Fe2+和Mn2+分别氧化成______(填化学式)。
(3)能否直接控制pH除去Mn2+______,理由__________。
(4)若检验时溶液呈红色,说明滤液B中还含有_______未除尽(填离子符号),应补加_______再煮沸趁热过滤(填化学式)。
(5)沉淀D的化学式_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是周期表的一部分,X、Y、Z、W、M均为短周期元素,X、Z的质子数之和是20。下列说法不正确的是

A. X是动植物生长不可缺少的元素,是蛋白质的重要组成元素
B. Z的最高价氧化物的水化物是两性氢氧化物,能溶于氨水
C. 气态氢化物的稳定性Y>W>M
D. M的最高价氧化物可用于光导纤维
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com