
【题目】七水硫酸镁(MgSO4·7H2O)可用于印染加重剂,制造瓷器、颜料和防火材料。在医药上用作泻剂,在徽生物工业作培养基成分等。可利用化工厂生产硼砂的废渣——硼镁泥制取七水硫酸镁(MgSO4·7H2O),硼镁泥的主要成分是MgCO3,还含有其它杂质(MgO、Na2B4O7、SiO2、Fe2O3、CaO、Al2O3、MnO等)。
硼镁泥制取七水硫酸镁的工艺流程图如下:

表l:部分阳离子开好成淀和完全沉淀时溶液的pH
Fe3+ | Fe2+ | Mn2+ | Mg2+ | Al3+ | |
开始沉淀的pH | 1.9 | 7.9 | 8.6 | 9.6 | 3.1 |
完全沉淀的pH | 3.2 | 9.0 | 10.l | 11 | 5.4 |
据此试回答下列问题:
(1)写出生成H3BO3的离子方程式______________。
(2)NaClO具有强氧化性,能直接将溶液中Fe2+和Mn2+分别氧化成______(填化学式)。
(3)能否直接控制pH除去Mn2+______,理由__________。
(4)若检验时溶液呈红色,说明滤液B中还含有_______未除尽(填离子符号),应补加_______再煮沸趁热过滤(填化学式)。
(5)沉淀D的化学式_______________。
【答案】 5H2O+B4O72-+2H+=4H3BO3 ↓ Fe(OH)3、MnO2 不能 当 Mn2+沉淀完全时,Mg2+也会以沉淀的形式从溶液中析出。 Fe2+ NaClO CaSO4
【解析】试题分析:本题以硼镁泥制取七水硫酸镁的工业流程为依托,重点考查离子方程式的书写、氧化还原反应基础知识、盐类水解在除杂中的应用、常见离子的检验等知识,考查考生对工业流程的分析能力、对试题的综合分析能力和对所学知识的应用能力。解题过程中首先要“吃透”工业流程。
解析:工业流程分析:硼镁泥在稀硫酸作用下,MgCO3、MgO、Na2B4O7、Fe2O3、CaO、Al2O3、MnO等分别反应生成对应的硫酸盐和H3BO3,SiO2不溶为固体,再次的硼镁泥与剩余的硫酸反应、NaClO氧化Mn2+生成MnO2,溶液中可能存在的少量Fe2+被氧化生成Fe3+,同时可以调节溶液的pH值到规定范围,如下图所示。
工业流程中物质转化关系如下:
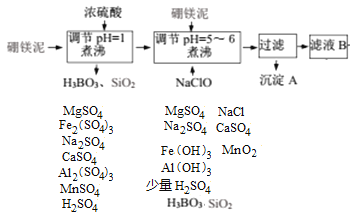
过滤除去的是不溶物Fe(OH)3、Al(OH)3、MnO2、H3BO3、SiO2等,B中主要存在MgSO4及少量Na2SO4、CaSO4、NaCl,适当浓缩、趁热过滤除去溶解度较小的CaSO4,滤液蒸发浓缩、冷却结晶时,析出MgSO4·7H2O。
(1)H3BO3来源于Na2B4O7与H2SO4溶液的反应,Na2B4O7+5H2O+H2SO4=4H3BO3↓+Na2SO4,反应的离子方程式是5H2O+B4O72-+2H+=4H3BO3 ↓ ,正确答案:5H2O+B4O72-+2H+=4H3BO3 ↓。(2)NaClO能够将Fe2+氧化生成Fe3+,而Fe3+在pH为3.2的溶液中就完全沉淀,此时溶液pH5~6,所以生成Fe(OH)3沉淀,Mn2+被氧化生成MnO2。正确答案:Fe(OH)3 MnO2。(3)直接除去Mn2+需要调节溶液pH达到10.1,Mg2+在pH达到9.6时就开始沉淀,因此Mn2+完全沉淀时,Mg2+也部分沉淀而损失,所以不能直接控制pH除去Mn2+。正确答案:不能 、 当 Mn2+沉淀完全时,Mg2+也会以沉淀的形式从溶液中析出。(4)检验时加入的KSCN是为了检验Fe3+,同时加入的H2O2、硫酸说明该Fe3+来源与Fe2+,即滤液B中含有Fe2+,因此第二步需要补加NaClO将Fe2+充分氧化,防止Fe2+盐混入产物中导致产物不纯。正确答案:Fe2+、NaClO。(5)根据上述工业流程分析,沉淀D为CaSO4。正确答案:CaSO4。


 七星图书口算速算天天练系列答案
七星图书口算速算天天练系列答案 初中学业考试导与练系列答案
初中学业考试导与练系列答案科目:高中化学 来源: 题型:
【题目】下列图示与对应的叙述相符的是( )
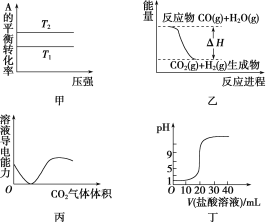
A.由图甲可以判断:对于反应A(g)+B(g) ![]() 2C(g),若T1>T2,则ΔH<0
2C(g),若T1>T2,则ΔH<0
B.图乙表示可逆反应CO(g)+H2O(g) ![]() CO2(g)+H2(g) ΔH>0
CO2(g)+H2(g) ΔH>0
C.图丙表示CO2通入饱和Na2CO3溶液中,溶液导电性变化
D.图丁表示0.1 mol·L-1的盐酸滴定20 mL 0.1 mol·L-1 NaOH溶液,溶液pH随加入盐酸体积的变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】膳食纤维具有突出的保健功能,称为人体的“第七营养素”。木质素是一种非糖类膳食纤维,其单体之一是芥子醇,结构简式如图所示。下列有关芥子醇的说法正确的是
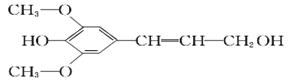
A. 芥子醇的分子式中有一种含氧官能团
B. 芥子醇分子中所有碳原子不可能在同一平面上
C. 芥子醇能与FeCl3溶液发生显色反应,且1mol芥子醇能够与3 mol的Br2水反应
D. 芥子醇能发生的反应类型有氧化、取代、加成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)火箭的第一、二级发动机中,所用的燃料为偏二甲肼和四氧化二氮,偏二甲肼可用肼来制备。
①用肼(N2H4)作燃料,四氧化二氮作氧化剂,两者反应生成氮气和气态水。
已知:N2(g)+2O2(g)===N2O4(g)
ΔH=+10.7 kJ·mol-1
N2H4(g)+O2(g)===N2(g)+2H2O(g)
ΔH=-543 kJ·mol-1
写出气态肼和N2O4反应的热化学方程式: ___________________。
②已知四氧化二氮在大气中或在较高温度下很难稳定存在,它很容易转化为二氧化氮。试推断出二氧化氮制取四氧化二氮的反应条件(或措施):___________________________。
(2)科学家制造出一种使用固体电解质的燃料电池,其效率更高,可用于航空航天。如图1所示装置中,以稀土金属材料作惰性电极,在两极上分别通入CH4和空气,其中固体电解质是掺杂了Y2O3的ZrO2固体,它在高温下能传导阳极生成的O2-离子(O2+4e-===2O2-)。

①c电极的名称为________,d电极上的电极反应式为_________________________。
②如图2所示为电解100 mL 0.5 mol·L-1CuSO4溶液,a电极上的电极反应式为____________________。若a电极产生56 mL(标准状况)气体,则所得溶液的pH=________(不考虑溶液体积变化),若要使电解质溶液恢复到电解前的状态,可加入________(填序号)。
a.CuO b.Cu(OH)2
c.CuCO3 d.Cu2(OH)2CO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于热化学反应的描述中正确的是
A. HCl和NaOH反应的中和热△H=-57.3kJ/mol,则H2SO4和Ba(OH)2反应的中和热也是△H=-57.3kJ/mol
B. CO(g)的燃烧热是283.0kJ/mol,则2CO2(g)=2CO(g)+O2(g) △H=+566kJ/mol
C. 需要加热才能发生的反应一定是吸热反应
D. 1mol甲烷燃烧生成气态水和二氧化碳所放出的热量是甲烷的燃烧热
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】燃煤烟气脱硫有很多方法
方法I:先用氨水将SO2转化为NH4HSO3,再通入空气氧化成(NH4)2SO4。
方法II:用Na2SO3溶液吸收S02,再经电解转化为H2SO4。
据此回答以下问题:
(1)方法I中发生氧化还原反应的离子方程式__________。能提高方法I燃煤烟气SO2中去除率的措施有__________(填字母)。
A.增大氨水浓度 B.增大燃煤烟气的流速
C.事先去除燃煤烟气中的二氧化碳 D.增大压强
(2)采用方法II脱硫,燃煤烟气中的二氧化碳能否与生成的NaHSO3溶液反应_______(说明理由)。已知H2SO3为的电离平衡常数为K1=1.54×10-2,K2=1.02×10-7。则NaHSO3溶液中含S元素粒子浓度由大到小的顺序为_______。通过右图所示电解装置可将生成的NaHSO3转化为硫酸,电极材料皆为石墨。则A为电解池的______(填“阴极”或“阳极”)。C为______(填物质名称)。若将阴离子交换膜换成阳子交换膜,写出阳极区域发生的电极反应______。

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com