
【题目】(1)火箭的第一、二级发动机中,所用的燃料为偏二甲肼和四氧化二氮,偏二甲肼可用肼来制备。
①用肼(N2H4)作燃料,四氧化二氮作氧化剂,两者反应生成氮气和气态水。
已知:N2(g)+2O2(g)===N2O4(g)
ΔH=+10.7 kJ·mol-1
N2H4(g)+O2(g)===N2(g)+2H2O(g)
ΔH=-543 kJ·mol-1
写出气态肼和N2O4反应的热化学方程式: ___________________。
②已知四氧化二氮在大气中或在较高温度下很难稳定存在,它很容易转化为二氧化氮。试推断出二氧化氮制取四氧化二氮的反应条件(或措施):___________________________。
(2)科学家制造出一种使用固体电解质的燃料电池,其效率更高,可用于航空航天。如图1所示装置中,以稀土金属材料作惰性电极,在两极上分别通入CH4和空气,其中固体电解质是掺杂了Y2O3的ZrO2固体,它在高温下能传导阳极生成的O2-离子(O2+4e-===2O2-)。

①c电极的名称为________,d电极上的电极反应式为_________________________。
②如图2所示为电解100 mL 0.5 mol·L-1CuSO4溶液,a电极上的电极反应式为____________________。若a电极产生56 mL(标准状况)气体,则所得溶液的pH=________(不考虑溶液体积变化),若要使电解质溶液恢复到电解前的状态,可加入________(填序号)。
a.CuO b.Cu(OH)2
c.CuCO3 d.Cu2(OH)2CO3
【答案】(1)①2N2H4(g)+N2O4(g)===3N2(g)+4H2O(g)
ΔH=-1 096.7 kJ·mol-1 ②高压、低温(或加压、降温)
(2)①正极 CH4-8e-+4O2-===CO2+2H2O
②4OH--4e-===2H2O+O2↑ 1 ac
【解析】(1)①N2(g)+2O2(g)===N2O4(g)
ΔH=+10.7 kJ·mol-1 Ⅰ
N2H4(g)+O2(g)===N2(g)+2H2O(g)
ΔH=-543 kJ·mol-1 Ⅱ
根据盖斯定律可知,所求反应的热化学方程式可以由Ⅱ×2-Ⅰ得到:2N2H4(g)+N2O4(g)===3N2(g)+4H2O(g) ΔH=-1 096.7 kJ·mol-1。②四氧化二氮在高温下很难稳定存在,而NO2生成N2O4的反应为气体体积减小的反应,故二氧化氮转化为四氧化二氮的条件可以是高压、低温。(2)①电流从正极流向负极,故c、d分别为正极、负极,燃料电池的负极为通入燃料的一极,故其电极反应式为CH4-8e-+4O2-===CO2+2H2O。②a为电解池的阳极:4OH--4e-===2H2O+O2↑;b为阴极:2Cu2++4e-===2Cu,当阳极产生56 mL气体时,被电解的OH-的物质的量为:![]() ×4=0.01 mol,故溶液中c(H+)=
×4=0.01 mol,故溶液中c(H+)=![]() =0.1 mol·L-1,故溶液的pH=1。此时阴极析出0.05 mol Cu,Cu2+恰好完全放电,为恢复电解质溶液的原状,根据“出什么加什么”原理,只要相当于加入CuO即可,a项可以,b项Cu(OH)2可以拆为CuO·H2O,c项CuCO3拆为CuO·CO2,d项Cu2(OH)2CO3可拆为2CuO·H2O·CO2,其中c项也可选。
=0.1 mol·L-1,故溶液的pH=1。此时阴极析出0.05 mol Cu,Cu2+恰好完全放电,为恢复电解质溶液的原状,根据“出什么加什么”原理,只要相当于加入CuO即可,a项可以,b项Cu(OH)2可以拆为CuO·H2O,c项CuCO3拆为CuO·CO2,d项Cu2(OH)2CO3可拆为2CuO·H2O·CO2,其中c项也可选。


 通城学典默写能手系列答案
通城学典默写能手系列答案科目:高中化学 来源: 题型:
【题目】天然气、可燃冰、页岩气、沼气的主要成分都是甲烷,甲烷既是一种清洁能源,也是一种重要的化工原料。
(1)以甲烷为主要原料可生产合成气(CO和H2)。
已知:①CH4(g)+2O2(g)===CO2(g)+2H2O(g)
ΔH=-802.3 kJ·mol-1
②CO(g)+H2O(g) ![]() CO2(g)+H2(g)
CO2(g)+H2(g)
ΔH=-41.0 kJ·mol-1
③2CO(g)+O2(g)===2CO2(g)
ΔH=-566.0 kJ·mol-1
则反应CO2(g)+CH4(g) ![]() 2CO(g)+2H2(g)的ΔH=__________________。
2CO(g)+2H2(g)的ΔH=__________________。
(2)以二氧化钛表面覆盖Cu2Al2O4为催化剂,可以将CO2和CH4直接转化成乙酸,反应方程式为CO2(g)+CH4(g) ![]() CH3COOH(g)。
CH3COOH(g)。
①在不同温度下催化剂的催化效率与乙酸的生成速率如图1所示。250~300 ℃时,温度升高而乙酸的生成速率降低的原因是_________________________。
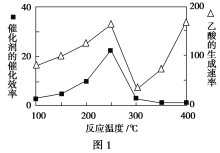
②为了提高该反应中CH4的转化率,可以采取的措施是______________________(写出一条即可)。
(3)甲烷燃料电池是一种新型电池。如图2所示,装置Ⅰ为甲烷燃料电池(电解质溶液为KOH溶液),通过装置Ⅱ可实现铁棒上镀铜。
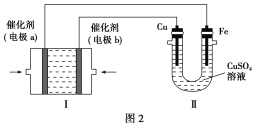
①电极b上的电极反应式是______________________。
②电镀结束后,装置Ⅰ中溶液的pH________(填“变大”、“变小”或“不变”,下同),装置Ⅱ中Cu2+的物质的量浓度______________。
③若完全反应后,装置Ⅱ中阴极质量增加12.8 g,则装置Ⅰ中理论上消耗的氧气在标准状况下的体积为________L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】七水硫酸镁(MgSO4·7H2O)可用于印染加重剂,制造瓷器、颜料和防火材料。在医药上用作泻剂,在徽生物工业作培养基成分等。可利用化工厂生产硼砂的废渣——硼镁泥制取七水硫酸镁(MgSO4·7H2O),硼镁泥的主要成分是MgCO3,还含有其它杂质(MgO、Na2B4O7、SiO2、Fe2O3、CaO、Al2O3、MnO等)。
硼镁泥制取七水硫酸镁的工艺流程图如下:

表l:部分阳离子开好成淀和完全沉淀时溶液的pH
Fe3+ | Fe2+ | Mn2+ | Mg2+ | Al3+ | |
开始沉淀的pH | 1.9 | 7.9 | 8.6 | 9.6 | 3.1 |
完全沉淀的pH | 3.2 | 9.0 | 10.l | 11 | 5.4 |
据此试回答下列问题:
(1)写出生成H3BO3的离子方程式______________。
(2)NaClO具有强氧化性,能直接将溶液中Fe2+和Mn2+分别氧化成______(填化学式)。
(3)能否直接控制pH除去Mn2+______,理由__________。
(4)若检验时溶液呈红色,说明滤液B中还含有_______未除尽(填离子符号),应补加_______再煮沸趁热过滤(填化学式)。
(5)沉淀D的化学式_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知An +,B(n+1) +,Cn -,D(n+1) -离子具有相同的电子层结构,则A、B、C、D的原子半径由大到小的顺序为 ( )
A. A>B>C>D B. C>D>B>A
C. A>B>D>C D. D>C>A>B
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是一个化学过程的示意图。

(1)图中甲池是________装置(填“电解池”或“原电池”),其中OH-移向________极(填“CH3OH”或“O2”)。
(2)写出通入CH3OH的电极的电极反应式: _______________________。
(3)向乙池两电极附近分别滴加适量紫色石蕊试液,附近变红的电极为________极(填“A”或“B”),并写出此电极的反应式:______________。
(4)乙池中总反应的离子方程式:____________。
(5)常温下,当乙池中B(Ag)极的质量增加5.40 g时,乙池的pH是________(若此时乙池中溶液的体积为500 mL);此时丙池某电极析出1.60 g某金属,则丙中的某盐溶液可能是________(填序号)。
A.MgSO4 B.CuSO4
C.NaCl D.AgNO3
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com