
【题目】在一定温度和压强下,10L气体A2跟20L气体B2化合生成20L某气体C,则气体C化学式为( )
A.AB2
B.A2B
C.AB3
D.AB
科目:高中化学 来源: 题型:
【题目】七水硫酸镁(MgSO4·7H2O)可用于印染加重剂,制造瓷器、颜料和防火材料。在医药上用作泻剂,在徽生物工业作培养基成分等。可利用化工厂生产硼砂的废渣——硼镁泥制取七水硫酸镁(MgSO4·7H2O),硼镁泥的主要成分是MgCO3,还含有其它杂质(MgO、Na2B4O7、SiO2、Fe2O3、CaO、Al2O3、MnO等)。
硼镁泥制取七水硫酸镁的工艺流程图如下:

表l:部分阳离子开好成淀和完全沉淀时溶液的pH
Fe3+ | Fe2+ | Mn2+ | Mg2+ | Al3+ | |
开始沉淀的pH | 1.9 | 7.9 | 8.6 | 9.6 | 3.1 |
完全沉淀的pH | 3.2 | 9.0 | 10.l | 11 | 5.4 |
据此试回答下列问题:
(1)写出生成H3BO3的离子方程式______________。
(2)NaClO具有强氧化性,能直接将溶液中Fe2+和Mn2+分别氧化成______(填化学式)。
(3)能否直接控制pH除去Mn2+______,理由__________。
(4)若检验时溶液呈红色,说明滤液B中还含有_______未除尽(填离子符号),应补加_______再煮沸趁热过滤(填化学式)。
(5)沉淀D的化学式_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是周期表的一部分,X、Y、Z、W、M均为短周期元素,X、Z的质子数之和是20。下列说法不正确的是

A. X是动植物生长不可缺少的元素,是蛋白质的重要组成元素
B. Z的最高价氧化物的水化物是两性氢氧化物,能溶于氨水
C. 气态氢化物的稳定性Y>W>M
D. M的最高价氧化物可用于光导纤维
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醇是一种可再生能源,具有开发和应用的广阔前景,工业上一般可采用如下反应来合成甲醇:CO(g)+2H2(g)![]() CH3OH(g)。
CH3OH(g)。
(1)下图是该反应在不同温度下CO的转化率随时间变化的曲线。

① 该反应的焓变ΔH____________0(填“<”、“>”或“=”)。② T1和T2温度下的平衡常数大小关系是K1____________K2(填“<”、“>”或“=”)。③ 若容器容积不变,下列措施可增加甲醇产率的是______________。
a.升高温度 b.将CH3OH(g)从体系中分离
c.使用合适的催化剂 d.充入He,使体系总压强增大
(2)一定温度下,向体积为2L的密闭容器中加入CO和H2,发生反应CO(g)+2H2(g)![]() CH3OH(g),达平衡后测得各组分浓度如下:
CH3OH(g),达平衡后测得各组分浓度如下:
物质 | CO | H2 | CH3OH |
浓度(molL-1) | 0.9 | 1.0 | 0.6 |
①平衡常数K=________________。
②若保持体积不变,再充入0.6molCO和0.4molCH3OH,此时V正______V逆(填“<”、“>”或“=”)。
(3)中国科学院长春应用化学研究所在甲醇燃料电池技术方面获得新突破,组装出了自呼吸电池及主动式电堆。甲醇燃料电池的工作原理如图所示。


① 该电池工作时,b口通入的物质为____________。
② 该电池正极的电极反应式为 ___________________。
③ 工作一段时间后,当3.2g甲醇完全反应生成CO2时,有___________NA个电子转移。
(4)以上述电池做电源,用下图所示装置,在实验室中模拟铝制品表面“钝化”处理的过程中,发现溶液逐渐变浑浊,原因是(用相关的电极反应式和离子方程式表示):_______________ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】H2S是一种剧毒气体,对H2S废气资源化利用途径之一是回收能量并得到单质硫,反应原理为:2H2S(g)+O2(g)=S2(s)+2H2O(l) H=-632kJ·mol-1。下图为质子膜H2S燃料电池的示意图。下列说法正确的是( )
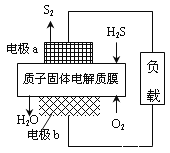
A. 电池工作时,电流从电极a经负载流向电极b
B. 电极a上发生的电极反应为:2H2S - 4e-=S2 + 4H+
C. 当反应生成64gS2时,电池内部释放632kJ热能
D. 当电路中通过4mol电子时,有4molH+经质子膜进入负极区
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是一个化学过程的示意图。

(1)图中甲池是________装置(填“电解池”或“原电池”),其中OH-移向________极(填“CH3OH”或“O2”)。
(2)写出通入CH3OH的电极的电极反应式: _______________________。
(3)向乙池两电极附近分别滴加适量紫色石蕊试液,附近变红的电极为________极(填“A”或“B”),并写出此电极的反应式:______________。
(4)乙池中总反应的离子方程式:____________。
(5)常温下,当乙池中B(Ag)极的质量增加5.40 g时,乙池的pH是________(若此时乙池中溶液的体积为500 mL);此时丙池某电极析出1.60 g某金属,则丙中的某盐溶液可能是________(填序号)。
A.MgSO4 B.CuSO4
C.NaCl D.AgNO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】表1是元素周期表的一部分:
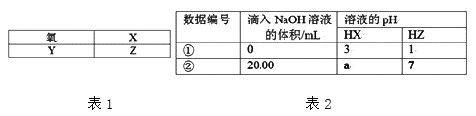
25℃时,用浓度为0.1000 mol/L的氢氧化钠溶液分别滴定20.00mL浓度均为0.1000 mol/L的两种酸HX、HZ(忽略体积变化),实验数据如表2,下列判断正确的是
A. 表格中a<7
B. HX和HZ等体积混合后pH=1+lg2
C. Y和Z两元素的简单氢化物受热分解,前者分解温度高
D. 0.l000mol/LNa2Y的水溶液中:c(Y2—)+c(HY—)+c(H2Y)=0.1000mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在xR2++yH++O2=4R3++nH2O的离子方程式中,下列判断正确的是 ( )
A. y=4,R2+是氧化剂 B. y=2,R2+是还原剂
C. y=2,R3+是还原产物 D. y=4,R3+是氧化产物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,将少量水加入下列物质中,相关量变化正确的是
A. AgCl悬浊液中 c(Cl-)变小 B. 0.1mol/LCH3COOH溶液中 c(H+)变小
C. 0.1mol/LNa2CO3c(HCO3-)变大 D. 0.1mol/LNH4Cl溶液中 n(OH-)变小
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com