
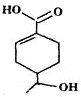
| A. | 分子中含有四种官能团 | |
| B. | 1mol该有机物完全燃烧消耗O2的物质的量为10mol | |
| C. | 能发生加成、取代、消去、水解等反应 | |
| D. | 相同条件下,等量的该有机物分别与足量的Na和NaHCO3溶液反应产生的气体的量相同 |
分析 A.分子中含有碳碳双键、羟基和羧基三种官能团;
B.该有机物的分子式为C9H13O3,根据方程式计算;
C.含有碳碳双键,可发生加成,含有羧基、羟基,可发生取代反应,不能发生水解反应;
D.只有羧基可与碳酸氢钠反应,1mol羧基与1mol碳酸氢钠反应产生1mol二氧化碳,羧基、羟基都可与钠反应,1mol羧基和羟基分别与钠反应共产生1mol氢气.
解答 解:A.分子中含有碳碳双键、羟基和羧基三种官能团,故A错误;
B.该有机物的分子式为C9H13O3,1mol该有机物完全燃烧消耗O2的物质的量为10.75mol,故B错误;
C.含有碳碳双键,可发生加成,含有羧基、羟基,可发生取代反应,不能发生水解反应,故C错误;
D.只有羧基可与碳酸氢钠反应,1mol羧基与1mol碳酸氢钠反应产生1mol二氧化碳,羧基、羟基都可与钠反应,1mol羧基和羟基分别与钠反应共产生1mol氢气,故D正确.
故选D.
点评 本题考查有机物的结构与性质,为高频考点,把握官能团与性质的关系为解答的关键,侧重烯烃、醇的性质考查,题目难度不大.


 备战中考寒假系列答案
备战中考寒假系列答案科目:高中化学 来源: 题型:解答题
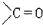 +RMgX→
+RMgX→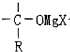 $\stackrel{H_{2}O}{→}$
$\stackrel{H_{2}O}{→}$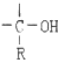
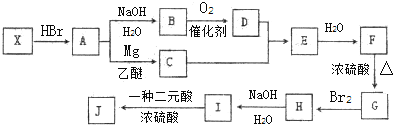
 ,
, .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
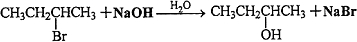
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯化钠 | B. | 硝酸按 | C. | 高锰酸钾 | D. | 硝酸钾 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氢化物的沸点:c>d | |
| B. | a、b、d的最高价氧化物对应的水化物两两皆能反应 | |
| C. | a、b、c的简单离子都会破坏水的电离平衡 | |
| D. | 简单离子的半径:c>d>a>b |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
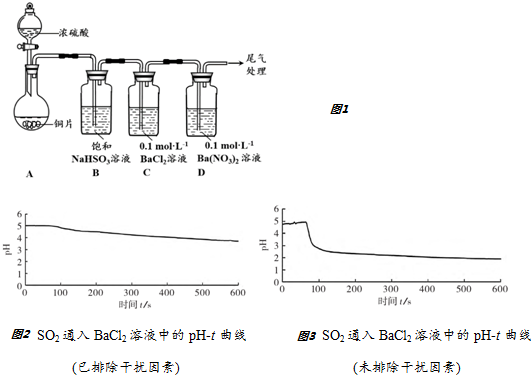
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
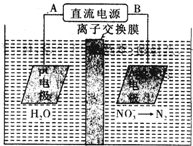
| A. | 电源正极为B | |
| B. | 若电解过程中转移了1mol电子,则膜两侧电解液的质量变化差(|△m左|-|△m右|)为7.2克 | |
| C. | Pt电极上产物为H2 | |
| D. | Ag-Pt电极上发生氧化反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
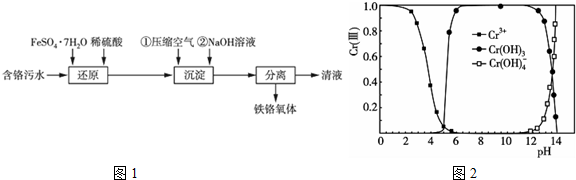
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 天然蛋白质中仅含C、H、0、N四种元素 | |
| B. | 加入(NH4)2S04饱和溶液会使蛋白质变性 | |
| C. | 重金属盐能使蛋白质凝结,所以误食重金属盐会中毒 | |
| D. | 鸡蛋清加入食盐,会使蛋白质变性 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com