
将标准状况下的aL HCl气体溶于1000g水中,得到的盐酸密度为b g·cm-3,则该盐酸的物质的量浓度是
A.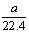 mo1·L-1 B.
mo1·L-1 B.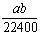 mol·L-1 C.
mol·L-1 C.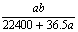 mol·L-1 D.
mol·L-1 D.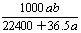 mol·L-1.
mol·L-1.
科目:高中化学 来源: 题型:
在N2+3H2 2NH3反应中,自反应开始至2 s末,氨的浓度由0变为0. 4 mol·L-1,则以氢气的浓度变化表示该反应在2s内的平均反应速率是( )
2NH3反应中,自反应开始至2 s末,氨的浓度由0变为0. 4 mol·L-1,则以氢气的浓度变化表示该反应在2s内的平均反应速率是( )
A.0.3 mol·L-1·s-1 B.0.4 mol·L-1·s-1
C.0.6 mol·L-1·s-1 D.0.8 mol·L-1·s-1
查看答案和解析>>
科目:高中化学 来源: 题型:
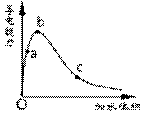
一定温度下,将一定质量的冰醋酸加水稀释过程中,溶液的导电能力变化如右图所示,下列说法正确的是
A.a、b、c三点溶液的pH:c<a<b
B.a、b、c三点醋酸的电离程度:a<b<c
C.用湿润的pH试纸测量a处溶液的pH,测量结果偏大
D.a、b、c三点溶液用1mol/L氢氧化钠溶液中和,消耗氢氧化钠溶液体积:c<a<b
查看答案和解析>>
科目:高中化学 来源: 题型:
用“>”、“=”、“<”填写。
(1)常温下,将0.1mol/L的醋酸溶液和0.1mol/L醋酸钠溶液等体积混合,测得溶液显酸性,则该混合液中:
c(CH3COOH) c(CH3COO-);
2c(Na+) c(CH3COO-)+c(CH3COOH);
(2)常温下,将0.1mol/L的HCN溶液和0.1mol/L的NaCN溶液等体积混合,测得混合液中c(HCN)>c(CN-),(假设混合过程中溶液体积的改变忽略不计)。则该混合液pH 7,c(HCN)+c(CN-) 0.1mol/L,c(HCN)-c(CN-) 2c(OH-)。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列实验操作中数据合理的是
A.用10 mL 量筒量取5.2 mL盐酸 B.用pH试纸测得某溶液的pH值为12.5
C.用托盘天平称取25.12gNaCl固体 D.用100 mL容量瓶配制50mL0.1 mol/L的盐酸
查看答案和解析>>
科目:高中化学 来源: 题型:
用NA表示阿伏德罗常数,下列叙述正确的是
A.标准状况下,22.4LH2O含有的分子数为 NA
B.常温常压下,1.06g Na2CO3含有的Na+离子数为0.02 NA
C.通常状况下,NA 个CO2分子占有的体积为22.4L
D.物质的量浓度为0.5 mol/L的MgCl2溶液中,含有Cl- 个数为 NA
查看答案和解析>>
科目:高中化学 来源: 题型:
9.75g锌与 mol的盐酸刚好完全反应,放出 mol H2,在溶液中有 mol Zn2+离子和 mol Cl-离子,把反应后的溶液蒸干,可以得到ZnCl2 mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是( )
A. 用铁片和稀硫酸反应制取氢气时,改用98%的浓硫酸可加快产生氢气的速率
B. 对于反应2H2O2 =2H2O+O2↑, 加入MnO2或升高温度都能加快O2的生成速率
=2H2O+O2↑, 加入MnO2或升高温度都能加快O2的生成速率
C. 将铜片放入稀硫酸中,无现象。若再向所得溶液中加入硝酸银溶液,一段时间后,由于形成原电池,可看到有氢气产生
D. 100mL 2mol/L的盐酸跟锌片反 应,加入适量的氯化钠溶液,反应速度不变
应,加入适量的氯化钠溶液,反应速度不变
查看答案和解析>>
科目:高中化学 来源: 题型:
次磷酸(H3PO2)是一种精细磷化工产品,具有较强还原性。回答下列问题:
(1)H3PO2是一种中强酸,写出其电离方程式:_____________________________
________________________________________________________________________。
(2)H3PO2及NaH2PO2均可将溶液中的Ag+还原为银,从而可用于化学镀银。
①H3PO2中,P元素的化合价为________。
②利用H3PO2进行化学镀银反应中,氧化剂与还原剂的物质的量之比为4∶1,则氧化产物为________(填化学式)。
③NaH2PO2为________(填“正盐”或“酸式盐”),其溶液显________(填“弱酸性”“中性”或“弱碱性”)。
(3)H3PO2的工业制法是:将白磷(P4)与Ba(OH)2溶液反应生成PH3气体和Ba(H2PO2)2,后者再与H2SO4反应。写出白磷与Ba(OH)2溶液反应的化学方程式:____________________________________________。
(4)H3PO2也可用电渗析法制备,“四室电渗析法”工作原理如图所示(阳膜和阴膜分别只允许阳离子、阴离子通过):
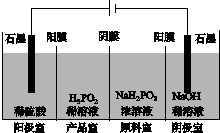
①写出阳极的电极反应式:_________________________________________。
②分析产品室可得到H3PO2的原因:_____________________________________
________________________________________________________________________。
③早期采用“三室电渗析法”制备H3PO2:将“四室电渗析法”中阳极室的稀硫酸用H3PO2稀溶液代替,并撤去阳极室与产品室之间的阳膜,从而合并了阳极室与产品室。其缺点是产品中混有________杂质,该杂质产生的原因是________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com