
【题目】某科研小组采用电解锰粉(主要成分为Mn和少量含Fe、Ni、Pb、P、Si等元素的单质或其化合物)为原料制备高纯氯化锰。
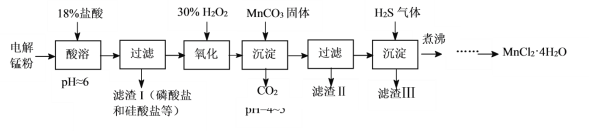
已知:①Mn是一种比Fe活泼的金属。
②H2S气体具有较强的还原性,如:H2S+H2O2=S↓+2H2O。
③相关金属离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为1.0mol·L-1计算)
Fe3+ | Fe2+ | Mn2+ | Ni2+ | Pb2+ | |
开始沉淀的pH | 1.1 | 5.8 | 8.6 | 6.7 | 8.0 |
沉淀完全的pH | 3.2 | 8.8 | 10.1 | 9.2 | 8.8 |
(1)酸溶时盐酸要缓慢滴加的原因是___。
(2)加入MnCO3固体时发生反应的离子方程式为___。MnCO3固体也可用下列物质代替___。(填写编号)
A.MnO B.MnSO4 C.Mn(OH)2 D.MnCl2
(3)通入H2S气体可使Pb2+、Ni2+生成硫化物沉淀,如:H2S(aq)+Pb2+(aq)![]() PbS(s)+2H+(aq),该反应的平衡常数K=___[用Ka1(H2S)、Ka2(H2S)及Ksp(PbS)表示]。
PbS(s)+2H+(aq),该反应的平衡常数K=___[用Ka1(H2S)、Ka2(H2S)及Ksp(PbS)表示]。
(4)煮沸的目的是___。
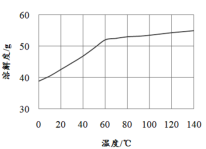
(5)已知MnCl2·4H2O在106℃时失去一分子结晶水,198℃失去全部结晶水。请补充完整由煮沸后的滤液获得高纯(>99.99%)MnCl2·4H2O晶体(MnCl2的溶解度曲线如图所示)的实验方案:将煮沸后的滤液冷却至室温,___(实验中须使用的试剂是:30%H2O2)。
【答案】防止活泼金属Mn与盐酸剧烈反应放出大量的热,避免盐酸大量挥发,使反应易于控制 3MnCO3+2Fe3++3H2O=3Mn2++2Fe(OH)3↓+3CO2↑ AC K=![]() 降低H2S的溶解度,减少S2-杂质 向其中缓慢滴加30%H2O2,搅拌,静置,向上层清液中继续滴加H2O2至无沉淀生成,过滤,将滤液加热至80℃(或60~100℃之间的任意一个温度)进行蒸发浓缩,冷却结晶,过滤,冰水洗涤,重结晶,低温烘干(或低于100℃烘干)。
降低H2S的溶解度,减少S2-杂质 向其中缓慢滴加30%H2O2,搅拌,静置,向上层清液中继续滴加H2O2至无沉淀生成,过滤,将滤液加热至80℃(或60~100℃之间的任意一个温度)进行蒸发浓缩,冷却结晶,过滤,冰水洗涤,重结晶,低温烘干(或低于100℃烘干)。
【解析】
根据流程:电解锰粉(主要成分为Mn和少量含Fe、Ni、Pb、P、Si等元素的单质或其化合物))在盐酸中酸浸,过滤,滤渣![]() I含有磷酸盐和硅酸盐,滤液含有Fe2+、Fe3+、Ni2+, Pb2+,加入H2O2将Fe2+氧化为Fe3+,加MnCO3调节pH4~5之间,除去Fe3+,滤渣II为Fe(OH)3,滤液中通入H2S除去Pb 2+和Ni2+,“滤渣III”的主要成分是NiS和PbS,滤液主要含有MnCl2,再进行加热浓缩、冷却结晶得到MnCl2·4H2O,据此分析作答。
I含有磷酸盐和硅酸盐,滤液含有Fe2+、Fe3+、Ni2+, Pb2+,加入H2O2将Fe2+氧化为Fe3+,加MnCO3调节pH4~5之间,除去Fe3+,滤渣II为Fe(OH)3,滤液中通入H2S除去Pb 2+和Ni2+,“滤渣III”的主要成分是NiS和PbS,滤液主要含有MnCl2,再进行加热浓缩、冷却结晶得到MnCl2·4H2O,据此分析作答。
(1)Mn是一种比Fe活泼的金属,它会与盐酸剧烈反应,且这是一个放热反应,温度升高过快会加剧盐酸的挥发,所以滴加时要注意缓慢操作,防止活泼金属Mn与盐酸剧烈反应放出大量的热,从而避免盐酸大量挥发,使反应易于控制,故答案为:防止活泼金属Mn与盐酸剧烈反应放出大量的热,避免盐酸大量挥发,使反应易于控制;
(2)流程图中加MnCO3后会生成CO2气体,此过程中会消耗H+,所以,它的作用是调节pH,从而使前一步中被H2O2氧化生成的Fe3+沉淀完全,离子方程式为3MnCO3+2Fe3++3H2O=3Mn2++2Fe(OH)3↓+3CO2↑;选择调节pH的试剂时要注意既要能消耗H+使pH增大,又不能引入杂质离子,所以A、C符合题意,故答案为:3MnCO3+2Fe3++3H2O=3Mn2++2Fe(OH)3↓+3CO2↑;AC;
(3)根据反应方程式得K=![]() ,又已知Ka1(H2S)=
,又已知Ka1(H2S)= ![]() ,Ka2(H2S)=
,Ka2(H2S)= ![]() ,Ksp(PbS)=c(Pb2+)
,Ksp(PbS)=c(Pb2+)![]() c(S2-), 通过变形出来得到K=
c(S2-), 通过变形出来得到K=![]() ,故答案为:K=
,故答案为:K=![]() ;
;
(4)在流程中,煮沸的作用通常是加快反应的速率、降低气体的溶解度使其逸出、促进某离子的水解、促进胶体的沉降等,本流程中,主要作用是降低H2S的溶解度,减少S2-杂质,故答案为:降低H2S的溶解度,减少S2-杂质;
(5)该小题为“物质制备的实验方案设计”。实验操作题中,所给的试剂往往有一定的提示作用,加之题目的已知②H2S气体具有较强的还原性,如:H2S+H2O2=S↓+2H2O,很明显的指出需要除去残余的S2-。MnCl2·4H2O在106℃时失去一分子结晶水,198℃失去全部结晶水,结合溶解度曲线,所以,蒸发浓缩时温度控制在100℃以内60℃以上较为合适,实际操作中可采用水浴加热,烘干时同样要注意低温。本题对产品纯度要求很高(>99.99%),故需要重结晶操作,故答案为:向其中缓慢滴加30%H2O2,搅拌,静置,向上层清液中继续滴加H2O2至无沉淀生成,过滤,将滤液加热至80℃(或60~100℃之间的任意一个温度)进行蒸发浓缩,冷却结晶,过滤,冰水洗涤,重结晶,低温烘干(或低于100℃烘干)。


科目:高中化学 来源: 题型:
【题目】某化学小组为了证明SO2和Cl2的漂白性,设计了如下图所示的实验装置:
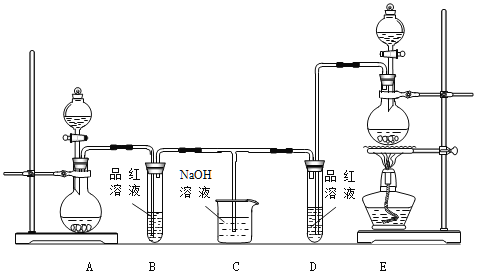
(1)他们制备Cl2依据的原理是:MnO2 + 4HCl(浓)![]() MnCl2 + 2H2O + Cl2↑,应选用上图A、E装置中的 (填序号)制Cl2,反应中浓盐酸所表现出的性质是 、 。
MnCl2 + 2H2O + Cl2↑,应选用上图A、E装置中的 (填序号)制Cl2,反应中浓盐酸所表现出的性质是 、 。
(2)反应开始后,发现B、D两个试管中的品红溶液都褪色,停止通气后,给B、D两个试管中的液体加热,B试管中的现象是 。
(3)NaOH溶液分别与两种气体反应的离子方程式是 、 。
(4)该小组同学将两种气体混合后通入品红溶液,一段时间后,品红溶液几乎不褪色。查阅资料得知:两种气体按体积比1:1混合,再与水反应可生成两种常见的酸,因而失去漂白作用,该反应的化学方程式是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列事实或操作不符合平衡移动原理的是( )
A. 开启啤酒有泡沫逸出
B. 向FeCl3溶液中加KSCN,有![]() Fe(SCN)3(血红色)+3KCl反应,平衡后向体系中加入KCl固体,使体系红色变浅
Fe(SCN)3(血红色)+3KCl反应,平衡后向体系中加入KCl固体,使体系红色变浅
C. 装有![]() 的烧瓶置于热水中颜色加深
的烧瓶置于热水中颜色加深
D. 实验室用排饱和食盐水的方法收集氯气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高铁酸钾(K2FeO4)既能消毒杀菌,又能净水,是一种理想的水处理剂。工业 上制备高铁酸钾的一种工艺流程如下:
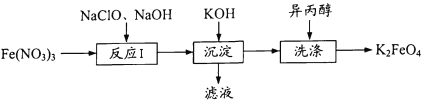
(1)K2FeO4中铁元素的化合价为 ____。
(2) “反应I”中参加反应的Fe3+与ClO-的物质的量之比为2 : 3,则滤液中含氯物质的化学式为____。写出“反应I”的离子方程式:_____。
(3)K2FeO4在水中发生反应:4K2FeO4+ 10H2O = 4Fe(OH)3 (胶体)+8KOH+3O2 ↑。高铁酸钾能消毒杀菌是因为____;它能净水是因为_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知反应2H2(g)+CO(g)![]() CH3OH(g)的平衡常数如下表。按照相同的物质的量投料,
CH3OH(g)的平衡常数如下表。按照相同的物质的量投料,
测得CO在不同温度下的平衡转化率与压强的关系如下图所示。下列大小比较正确的是
平衡常数 | 温度/℃ | ||
500 | 700 | 800 | |
K | 2.50 | 0.34 | 0.15 |
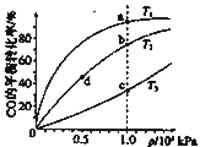
A.平横常数:K(a)>K(c),K(b)=K(d)
B.正反应速率:v(a)>v(c),v(b)=v(d)
C.达到平衡所需时间:t(a)=t(c),t(b)>t(d)
D.平均相对分子质量:M(a)=M(c),M(b)>M(d)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种由CuO和KHC2O4溶液反应的到的蓝色结晶[KaCub(C2O4)cdH2O]。为测定其组成,进行了如下实验:
步骤1称取3.5400 g该晶体,加入过量稀硫酸,待样品完全溶解后加入适量水,配制成100 mL溶液A.
步骤2量取20.00 mLA溶液,滴加0.2000 mol L-1 KMnO4溶液至恰好完全反应时,消耗KMnO4溶液8.00 mL。
步骤3另取20.00 mLA溶液,加入足量NaOH溶液,充分反应后,经过滤、洗涤、灼烧、称重,得到黑色固体粉末0.16 g。
己知:步骤2 中发生反应:2MnO4- + 5H2C2O4 + 6H+ = 2Mn2+ +10CO2↑ + 8H2O。
(1)步骤1中配制溶液A时,需要用到的玻璃仪器有烧杯、玻璃棒、_____。
(2)3.5400 g 该样品中含 n(C2O42-)= ____mol。
(3)3.5400 g 该样品中含 n(Cu2+)= ____mol。
(4)通过计算确定该蓝色晶体的化学式__________(计算过程)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列指定反应的离子方程式正确的是( )
A.用饱和Na2CO3溶液浸泡CaSO4固体:CO![]() +CaSO4
+CaSO4![]() CaCO3+SO
CaCO3+SO![]()
B.向NH4HCO3溶液中加入足量石灰水:Ca2++HCO![]() +OH-=CaCO3↓+H2O
+OH-=CaCO3↓+H2O
C.向CuSO4溶液中加过量的氨水:Cu2++2NH3·H2O=Cu(OH)2↓+2NH![]()
D.用碘化钾淀粉溶液检验亚硝酸钠中NO![]() 的存在:NO
的存在:NO![]() +2I-+2H+=NO↑+I2+H2O
+2I-+2H+=NO↑+I2+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)乙烯能使酸性高锰酸钾溶液和溴的四氯化碳溶液褪色,其中,与高锰酸钾发生的反应是________反应(填反应类型,下同);与溴发生的反应是________反应。在一定的条件下,乙烯还能发生________反应,生成聚乙烯。
(2)一种能使溴水褪色的气态烃,标准状况下5.6 L的质量为10.5 g,10.5 g该烃完全燃烧时生成16 .8 L二氧化碳和13.5 g水。则该烃的分子式为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】无机化合物可根据其组成和性质进行分类
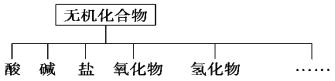
(1)图中所示的物质分类方法的名称是________。
(2)以Na、K、H、O、S、N中任两种或三种元素组成合适的物质,分别填在下表中②③⑥后面。
物质类别 | 酸 | 碱 | 盐 | 氧化物 | 氢化物 |
化学式 | ①HCl ②____ | ③________ ④Ba(OH)2 | ⑤Na2CO3 ⑥______ | ⑦CO2 ⑧Na2O | ⑨NH3 ⑩H2O2 |
(3)写出⑦转化为⑤的化学方程式:___________。
(4)实验室制备⑦常用______和______反应,检验该气体的方法是____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com