
【题目】下列叙述中正确的是( )
A. 同一周期中,第ⅦA族元素的原子半径最大
B. 第ⅥA族元素的原子,其半径越大,越容易得到电子
C. 室温时,0族元素的单质都是气体
D. 同一周期中,碱金属元素的第一电离能最大
科目:高中化学 来源: 题型:
【题目】以酸性氢氧燃料电池为电源进行电解的实验装置如图所示。下列说法正确的是( )
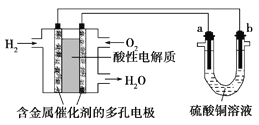
A. 燃料电池工作时,正极反应为O2+2H2O+4e-===4OH-
B. a极是粗铜,b极是纯铜时,a极逐渐溶解,b极上有铜析出
C. 电解过程中SO42— 移向b极
D. a、b两极若是石墨,在相同条件下a极产生的气体与电池中消耗的H2体积相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)现有标准状况下以下五种物质:①44.8L甲烷(CH4)②6.02×1024个水分子③196g H2SO4④0.5mol CO2,它们中含分子数最多的是(填写序号,下同)____,原子数最少的是____,体积最大的是_____。
(2)①CO2 ②Na2CO3溶液 ③NaOH 固体 ④CaCO3 ⑤CH3COOH ⑥NH3·H2O ⑦乙醇 ⑧液态氯化氢
属于电解质的有___________________;非电解质的有___________________。(填序号)
(3)用双线桥法表示出下列反应的电子转移方向和数目_____________。3S+6KOH![]() K2SO3+2K2S+3H2O
K2SO3+2K2S+3H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、M、R 为周期表前四周期原子序数依次增大的五种元素,X 与其他四种元素不同周期不同主族,M原子最外层2p轨道上有两个未成对电子,Y 易与M形成两种常见的化合物,R 在周期表的第9列。回答下列问题:
(1)R 基态原子M 能层的电子排布式为_________________,其原子核外共有_________种能量的电子。
(2)Y、M均可与X形成18e-的分子,其中属于极性分子的为_____________(填化学式),分子中Y、M 两种原子杂化方式依次为___________、_________________。
(3)Z 与M可形成的两种常见酸根离子的几何构型为__________、____________。
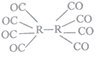
(4)R可形成原子簇化合物R2(CO)8,其沸点为52℃,不溶于水,易溶于乙醇、苯、二硫化碳等,是一种重要的有机合成催化剂,其结构如图,则该化合物属于_________晶体,该晶体中存在的作用力有___________(填标号)。
a.离子键 b.配位键 Cσ键 d.π键 e.氢键 f.范德华力
(5)单质R的晶胞有两种:417℃以下的晶胞结构如图1,417℃以上的晶胞结构如图2,后者配位数是_____________。若前者晶胞参数为ɑpm和c pm,单质R的摩尔质量为Mg·mol-1,阿伏加德罗常数为NA,则前者晶体密度p=_________g·cm-3(列出计算式即可)。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国古代就有湿法炼铜的记载“曾青得铁则化为铜”,反应为Fe + CuSO4 = Cu + FeSO4。有关该反应的说法正确的是( )
A.Fe被还原B.Fe是还原剂C.CuSO4发生氧化反应D.CuSO4失去电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2017年我国通过蛟龙一号在东海试采可燃冰成功,可燃冰的主要成分是甲烷。下列说法不正确的是( )
A.甲烷属于烃类B.甲烷是天然气的主要成分
C.甲烷能发生取代反应D.甲烷能使酸性高锰酸钾溶液褪色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在标准状况下,下列四种气体的关系中,从大到小的是
①6.72L CH4 ②3.01×1023个HCl分子 ③13.6g H2S ④0.2mol NH3
A. 体积:④>①>②>③
B. 密度:②>③>④>①
C. 质量:②>①>③>④
D. 氢原子数:①>②>③>④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是
A.催化剂可以改变化学反应速率
B.2 mol SO2与l mol O2混合一定能生成2 mol SO3
C.食物放在冰箱中会减慢食物变质的速率
D.化学反应达到反应限度时,正反应的速率与逆反应的速率相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有一定量含有Na2O杂质的Na2O2试样,用下图所示的实验装置测定Na2O2试样的纯度(通过CO2与样品反应后生成O2的量测定Na2O2的含量)。(可供选用的反应物:CaCO3固体、6 mol·L-1盐酸、6 mol·L-1硫酸和蒸馏水)

回答下列问题:
(1)实验前必须先_________。
(2)装置A中液体试剂应选用_____。
(3)装置B的作用是_________;装置C的作用是____;装置E中碱石灰的作用是__________。
(4)装置D中发生反应的化学方程式是___________。
(5)若开始时测得样品的质量为2.0 g,反应结束后测得气体体积为224 mL(标准状况),则Na2O2试样的纯度为________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com