
【题目】以酸性氢氧燃料电池为电源进行电解的实验装置如图所示。下列说法正确的是( )
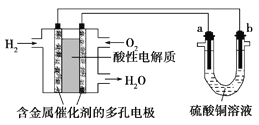
A. 燃料电池工作时,正极反应为O2+2H2O+4e-===4OH-
B. a极是粗铜,b极是纯铜时,a极逐渐溶解,b极上有铜析出
C. 电解过程中SO42— 移向b极
D. a、b两极若是石墨,在相同条件下a极产生的气体与电池中消耗的H2体积相等
科目:高中化学 来源: 题型:
【题目】某研究小组按下列路线合成药物奥沙拉秦:
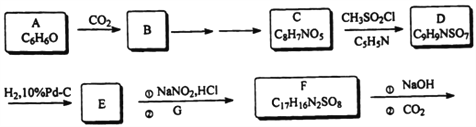
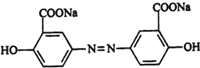 奥沙拉秦
奥沙拉秦
己知:(1)物质G是由物质B转化为物质C的一种中间产物
(2)R-NO2 ![]() R-NH2
R-NH2
(3)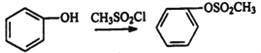
请回答:
(1)化合物A的结构简式_________________________。
(2)下列说法正确的是___________。
A.化合物A→B的反应是取代反应
B.化合物E既可以与HCl,可以与NaOH溶液反应
C.化合物F遇到FeCl3能发生显色反应
D.奥沙拉秦的分子式是C14H8N2O6Na2
(3)设计由化合物B生成化合物C的合成路线(用流程图表示,试剂任选)______________。
(4)写出C→D的化学方程式_____________________________________。
(5)化合物C可能的同分异构体的结构简式________________,须同时符合:
①1H-NMR谱表明分子中有3 种氢原子;
②IR谱显示含有苯环,N原子不与苯环直接相连接,乙酰基(CH3CO-);
③遇到FeCl3显色。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了制备氯气,某同学查阅资料发现实验室里常用浓盐酸与二氧化锰反应来制取少量的氯气,反应的化学方程式为:MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O。
MnCl2+Cl2↑+2H2O。
(1)请用双线桥法对该反应进行标注________________。
(2)写出该反应的离子方程式________________。
(3)该反应中,氧化剂和还原剂之比是________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关苯的说法错误的是( )
A.苯可以燃烧
B.苯分子的结构是平面正六边形
C.苯具有较强挥发性,有毒
D.苯的结构中含有碳碳双键,可以使溴水褪色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某实验兴趣小组将无水FeCl3与氯苯混合发生反应制备常用还原剂FeCl2,反应原理是:2FeCl3+C6H5Cl![]() 2FeCl2+C6H4Cl2+HCl↑。按照如图装置,在三颈烧瓶中放入162.5g无水FeCl3和225g氯苯,控制反应温度在130℃下加热3h,冷却、过滤、洗涤、干燥得到粗产品。将生成的HCl用水吸收,利用莫尔法可以测出无水FeCl3的转化率(莫尔法是用硝酸银标准溶液测定卤离子含量的沉淀滴定法)。
2FeCl2+C6H4Cl2+HCl↑。按照如图装置,在三颈烧瓶中放入162.5g无水FeCl3和225g氯苯,控制反应温度在130℃下加热3h,冷却、过滤、洗涤、干燥得到粗产品。将生成的HCl用水吸收,利用莫尔法可以测出无水FeCl3的转化率(莫尔法是用硝酸银标准溶液测定卤离子含量的沉淀滴定法)。
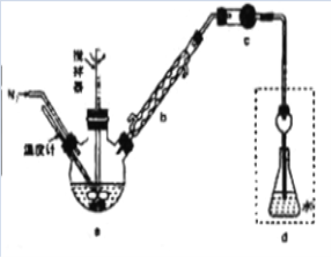
已知有关数据如下:
C6H5Cl | C6H4Cl2 | |
熔点/℃ | -45 | 53 |
沸点/℃ | 132 | 173 |
回答下列问题:
(1)仪器b的作用是_______。干燥管c中盛装的试剂是________。
(2)反应结束后需向反应器a中吹入干燥的氮气,其目的是_________。
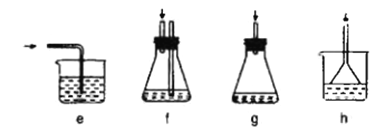
(3)下列各装置(盛有蒸馏水)能代替图中虚线框内部分的是_____(填序号)。
(4)从滤液中回收过量氯苯的操作是___________。
(5)将锥形瓶内溶液的pH调至6.0再加水稀释至1000mL,从中取10.0mL滴加几滴指示剂,用 0.2000mol/LAgNO3溶液进行滴定,当达到终点时,消耗22.50mLAgNO3溶液。
AgCl | AgBr | AgI | Ag2CrO4 | |
Ksp | 2×10-10 | 5.4×10-13 | 8.3×10-17 | 2×10-12 |
颜色 | 白 | 淡黄 | 黄 | 砖红 |
①参照上表已知信息用硝酸银标准溶液滴定氯离子含量时可以作指示剂的是___(填字母)。
a.CaCl2 b.NaBr c.NaI d.K2CrO4
②滴定达终点的现象是_______
③无水FeC13的转化率a=_______%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金属钛被称为“21世纪金属”。工业上由钛铁矿(主要成分FeTiO3)制备TiCl4的主要工艺流程如下:
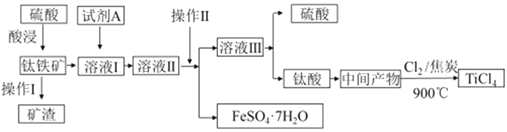
回答下列问题:
(1)已知酸浸反应FeTiO3(s)+2H2SO4(aq)=FeSO4(aq)+TiOSO4(aq)+2H2O,则FeTiO3中铁元素的化合价为_____。加热TiOSO4溶液可制备TiO2·nH2O胶体,其反应的化学方程式为__________。为提高钛铁矿的酸浸出率,可采取的办法除粉碎矿石外,还可以采取的办法有__________、_______(写出两种方法)。
(2)加入A的目的是____(填字母)。
A.防止Fe2+被氧化 B.与Fe3+反应 C.防Fe2+水解
溶液II经操作II可得副产品FeSO4·7H2O,则操作II包括浓缩、冷却、_____、_____。
(3)常温下,若溶液II中Fe2+的浓度为0.49mol/L,为防止生成Fe(OH)2沉淀,溶液的pH不超过_____。(已知Ksp[Fe(OH)2]=4.9×10-17)
(4)钛酸煅烧得中间产物的化学方程式为H2TiO3(s) ![]() TiO2(s)+H2O(g),上述工艺流程中,氯气与焦炭均足量时生成TiCl4的化学方程式为__________________________。
TiO2(s)+H2O(g),上述工艺流程中,氯气与焦炭均足量时生成TiCl4的化学方程式为__________________________。
(5)可利用TiO2通过下述两种方法制备金属钛:
方法一: 通过以下反应制备金属钛
①TiO2 (s)+2Cl2(g) ![]() TiCl4(g)+O2(g) △ H=+151kJ/mol
TiCl4(g)+O2(g) △ H=+151kJ/mol
②TiCl4+2Mg![]() 2MgCl2+Ti
2MgCl2+Ti
方法二:将TiO2作阴极,石墨作阳极,熔融CaO为电解液,碳块作电解槽池,电解TiO2制得钛,阳极上一定生成的气体是___________,可能生成的气体是______________。
从绿色化学角度,你认为上述两种方法中那种更好,并说明理由___________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于原电池的叙述中错误的是( )
A.构成原电池的正极和负极必须是两种不同的金属
B.原电池是将化学能转变为电能的装置
C.在原电池中,电子流出的一极是负极,发生氧化反应
D.原电池放电时,电流的方向是从正极到负极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图表示用CuSO45H2O晶体来配制480mL 0.20mol·L-1 CuSO4溶液的几个关键实验步骤和操作,据图回答下列问题:

(1)将上述实验步骤A~F按实验过程先后次序排列 __________________,需称取CuSO45H2O 晶体的质量为__________ g。
(2)写出配制480mL0.20mol·L-1CuSO4溶液所需要用到的玻璃仪器的名称:烧杯、量筒、_______________。
(3)步骤B通常称为转移,若是配制NaOH溶液,用水溶解NaOH固体后未冷却至室温即转移,配制溶液的浓度将偏_____________(填“高”或“低”)。步骤A通常称为____________,如果俯视刻度线,配制的浓度将偏______(填“高”或“低”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述中正确的是( )
A. 同一周期中,第ⅦA族元素的原子半径最大
B. 第ⅥA族元素的原子,其半径越大,越容易得到电子
C. 室温时,0族元素的单质都是气体
D. 同一周期中,碱金属元素的第一电离能最大
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com