
【题目】下列各组中的离子能大量共存且溶液呈无色的是( )
A.Na+、Ba2+、Cl-、SO42-B.Cu2+、H+、NO3-、SO42-
C.H+、Fe2+、NO3-、SO42-D.Na+、Ca2+、Cl-、NO3-
科目:高中化学 来源: 题型:
【题目】用乙炔为原料,制取CH2Br-CHBrCl,可行的反应途径是( )
A.先加Cl2,再加Br2B.先加Cl2,再加HBr
C.先加HCl,再加HBrD.先加HCl,再加Br2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.铁是生产、生活及生命中的重要元素。
(1)血红蛋白(Hb)中的铁元素呈正二价,能与O2分子结合成氧合血红蛋白(HbO)从而有输送氧的能力。NaNO2因具有氧化性能使血红蛋白丧失与O2结合能力。药品美蓝是其有效的解毒剂,解毒时美蓝发生_____反应(填“氧化”或“还原”)。
(2)现有一瓶放置了一段时间的某浓度的FeCl3溶液,请设计实验检验其中是否含有Fe3+_____。
(3)普通铁粉与水蒸气在高温下反应生成铁的某种氧化物和氢气,该氧化物和氢气在高温下发生逆反应得到“引火铁”。若一定量的普通铁粉和水蒸气在高温下反应生成44.8LH2(已换算到标况下),则转移电子数目为_______;“引火铁” 是一种极细的铁粉,它在空气中可以自燃,其原因是_____________。
II.化合物M是某种具有磁学性质的新型电子材料的主要成分,由两种元素组成。为了研究其组成,设计如下实验:
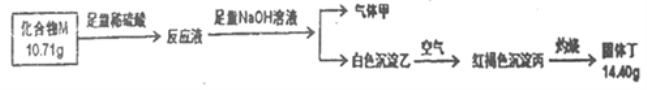
气体甲可使湿润红色石蕊试纸交蓝。请回答:
(1)M的化学式___________,气体甲的电子式__________。
(2)白色沉淀乙在空气中变成红褐色沉淀丙的原因是(用化学方程式表示)_______________。(3)高温条件下,丁与甲反应生成两种单质和水,该反应的化学方程式为______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铈(Ce)是镧系金属元素。空气污染物NO通常用含Ce4+的溶液吸收,生成HNO2、NO3ˉ,再利用电解法将上述吸收液中的HNO2转化为无毒物质,同时生成Ce4+,其原理如图所示。下列说法正确的是
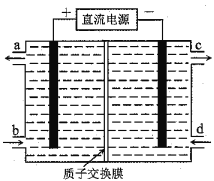
A. H+由右室进入左室
B. Ce4+从电解槽的c口流出,且可循环使用
C. 阴极的电极反应式:2HNO2+6H++6eˉ=N2↑+4H2O
D. 若用甲烷燃料电池作为电源,当消耗标准状况下33.6L甲烷时,理论上可转化HNO22mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铍铜是广泛应用于制造高级弹性元件的良好合金。某科研小组从某废旧铍铜元件(含BeO:25%、CuS:71%、少量FeS和SiO2)中回收铍和铜两种金属的工艺流程如下:

已知:I.铍、铝元素化学性质相似
II.常温下:Ksp[Cu(OH)2]=2.2×10-20、Ksp[Fe(OH)3]=4.0×10-38、Ksp[Mn(OH)2]=-2.1×10-13
(1)滤液A的主要成分除NaOH外,还有_____ (填化学式),写出反应I中含铍化合物与过量盐酸反应的离子方程式_____________。
(2)①溶液C中含NaCl、BeCl2和少量HCl,为提纯BeCl2,选择最合理步骤顺序______。
a.加入过量的NaOH b.通入过量的CO2 c.加入过量的氨水
d.加入适量的HC1 e.过滤 f.洗涤
②从BeCl2溶液中得到BeCl2固体的操作是________________。
(3)①MnO2能将金属硫化物中的硫元素氧化为硫单质,写出反应II中CuS 发生反应的化学方程式______________。
②若用浓HNO3溶解金属硫化物,缺点是____________(任写一条)。
(4)溶液D中含c(Cu2+)=2.2mol/L、c(Fe3+)=0.008mol/L c(Mn2+)=0.01mol/L,逐滴加入稀氨水调节pH可依次分离,首先沉淀的是___ (填离子符号),为使铜离子开始沉淀,常温下应调节溶液的pH值大于____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【选做-选修3:物质结构与性质】硒化锌是一种半导体材料,回答下列问题。
(1)锌在周期表中的位置_______;Se基态原子价电子排布图为______。元素锌、硫和硒第一电离能较大的是________(填元素符号)。
(2)Na2SeO3分子中Se原子的杂化类型为_______;H2SeO4的酸性比H2SeO3强,原因是_______。
(3)气态SeO3分子的立体构型为_______;下列与SeO3互为等电子体的有__(填序号)。
A.CO32- B.NO3- C.NCl3 D.SO32-
(4)硒化锌的晶胞结构如图所示,图中X和Y点所堆积的原子均为______(填元素符号);该晶胞中硒原子所处空隙类型为_____(填“立方体”、“正四面体”或正八面体”);若该品晶胞密度为ρg/cm3,硒化锌的摩尔质量为Mg/mol。用NA代表阿伏加德罗常数的数值,则晶胞参数a为_______nm。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列化学反应的离子方程式正确的是
A. 钠和冷水反应:Na+2H2O=Na++2OH﹣+H2↑
B. 用小苏打治疗胃酸过多:![]() +H+=CO2↑+H2O
+H+=CO2↑+H2O
C. 氯化铝溶液中加入过量氨水:Al3++3OH﹣=Al(OH)3↓
D. 三氯化铁溶液中加入铁粉:Fe3++Fe=2Fe2+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于糖类、油脂、蛋白质的叙述中,正确的是( )
A.油脂和纤维素均属于天然高分子
B.葡萄糖、蔗糖和蛋白质均能发生水解反应
C.在加热条件下葡萄糖可与新制的氢氧化铜反应
D.淀粉、油脂和蛋白质都只含C、H、O三种元素
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某些化学试剂可用于净水。水处理中使用的一种无机高分子混凝剂的化学式可表示为[Al2(OH) nClm·yH2O]X,式中m等于
A. 3-n B. 6-n C. 6+n D. 3+n
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com