
����Ŀ��һ��̫���ܵ�صĹ���ԭ������ͼ��ʾ�������Ϊ���軯��K3[Fe(CN)6]�������軯��K4[Fe(CN)6]�Ļ����Һ������˵������ȷ����
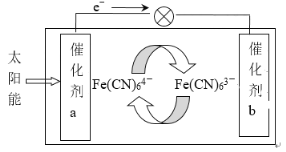
A.K+ �������b
B.����a���淢���Ļ�ѧ��Ӧ��Fe(CN)64--e-�� Fe(CN)63-
C.Fe(CN)63- �ڴ���b���汻����
D.������Һ�е�Fe(CN)64- ��Fe(CN)63- Ũ�Ȼ������ֲ���
���𰸡�C
��������
��ͼ��֪�����ӴӸ���������������aΪ������bΪ������
A��ԭ��ص��ڵ�·�У��������������ƶ���ͼ��̫���ܵ��bΪ��������K+�������b��A��ȷ��
B��aΪ����������������Ӧ�����ڴ���a���淢����ӦFe(CN)64--e-��Fe(CN)63-��B��ȷ��
C��b�Ϸ�����ԭ��Ӧ��Fe(CN)63-+e-=Fe(CN)64-��Fe(CN)63���ڴ���b���汻��ԭ��C����
D����B��Cѡ���еĵ缫��Ӧ��֪��Fe(CN)64-��Fe(CN)63-������1��1�ת�������Һ��Fe(CN)64-��Fe(CN)63-Ũ�Ȼ������ֲ��䣬D��ȷ��
��ѡC��


 ����ѧ��ţ��Ӣ��ϵ�д�
����ѧ��ţ��Ӣ��ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ҹ���ѧ�������CO2�û���ȼ��(mCH4��nH2O) ��CH4�����룬�û�������ͼ��ʾ������˵����ȷ����
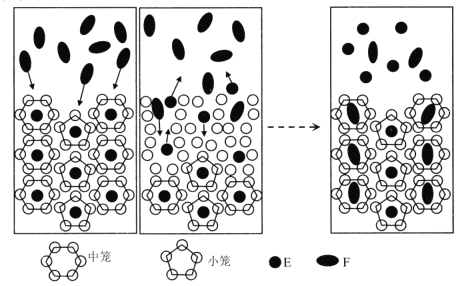
A.E����CO2�� F����CH4
B.��״�ṹ��ˮ���Ӽ���Ҫ��������
C.CO2�û���CH4�Ĺ����ǻ�ѧ�仯
D.CO2���û���ȼ�������е�CH4����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������������̻ش�
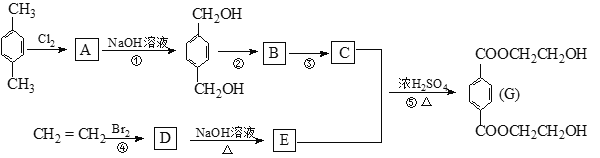
(1) д���ṹ��ʽ C______ E_________��
(2)ָ����Ӧ���ͣ� �� ___________ �� _____________ �� ____________
(3)д����ѧ����ʽ C + E ![]() G____________
G____________
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����һ��������þ�����Ļ����Ͷ��100ml�����У�����ȫ���ܽ����������Һ�м���NaOH��Һ�����ɳ��������ʵ��������NaOH��Һ�������ϵ��ͼ��ʾ��
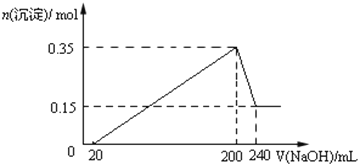
��1��ԭ�������þ������������Ϊ_______
��2��NaOH��Һ�����ʵ���Ũ��Ϊ_______ molL��1
��3�����ɵ������ڱ�״���µ����Ϊ_______ L��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����NAΪ�����ӵ�������ֵ������˵����ȷ����
A.��״���£�22.4 L SO3����NA������
B.���³�ѹ�� 4.4 g��ȩ����������ĿΪ0.6 NA
C.�ܱ�������2 mol NO��1 mol O2��ַ�Ӧ�����������Ϊ2 NA
D.18 g D2O�к��е�������Ϊ10 NA
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪������(C2H5Br)����ɫҺ�壬�е�38.4�棬�ܶȱ�ˮ��������ˮ�������ڶ����л��ܼ�������������NaOH�Ҵ���Һ����ȥ��Ӧ�п��Թ۲쵽���������ɡ������������ͼ��ʾ��װ�ã���KMnO4������Һ�Ƿ���ɫ���������ɵ������Ƿ�����ϩ��
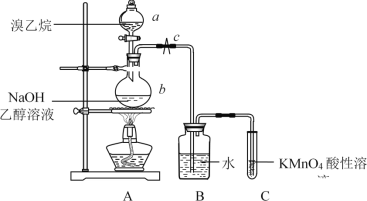
��ش��������⣺
(1)����a������Ϊ__________��
(2)ʵ��ǰӦ���װ��A�������ԡ��������£��ر�ֹˮ��c��������a������b�м�ˮ����______________________________����֤��װ��A��©����
(3)����b�з�����Ӧ�Ļ�ѧ����ʽΪ______________________________��
(4)��Ӧ��ʼһ��ʱ�����װ��B�ײ������˽϶����״Һ�壬���������״Һ����������ɶ�װ��A���θĽ���__________________________________________________
(5)װ��A�в���������ͨ��װ��C֮ǰҪ��ͨ��װ��B��װ��B������Ϊ__________________��
(6)������ϩ����KMnO4������Һ���ѡ�õ��Լ���__________����ʱ���Ƿ��б�Ҫ��������ͨ��װ��B��__________(����������������)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������NaOH��AlCl3��MgCl2���ֹ�����ɵĻ�����������ˮ�У���0.58g��ɫ���������������õ���Һ�У���μ���0.5mol/L �����ᣬ�����������������ɳ�����������ͼ��ʾ��
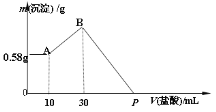
(1)�������NaOH��������_______g
(2)AlCl3�����ʵ�����____________ mol
(3)MgCl2�����ʵ�����___________ mol
(4)P������ʾ����������Ϊ___________ mL
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Li4Ti5O12��LiFePO4��������ӵ�صĵ缫���ϣ���������������Ҫ�ɷ�ΪFeTiO3������������MgO��SiO2�����ʣ����Ʊ��������������£�
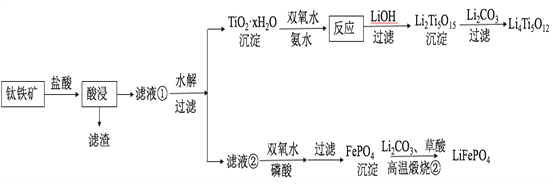
�ش��������⣺
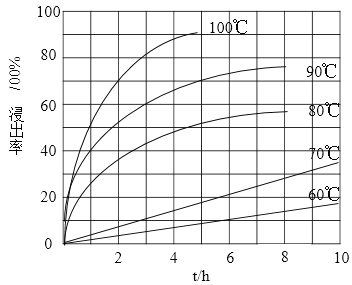
��1���������ʵ���У����Ľ����ʽ������ͼ��ʾ����ͼ��֪�������ľ�����Ϊ70%ʱ�������õ�ʵ������Ϊ___________________��
��2���������������Ҫ��TiOCl42����ʽ���ڣ�д����Ӧ��Ӧ�����ӷ���ʽ__________________��
��3��TiO2��xH2O������˫��ˮ����ˮ��Ӧ40 min����ʵ�������±���ʾ��
�¶�/�� | 30 | 35 | 40 | 45 | 50 |
TiO2��xH2Oת����% | 92 | 95 | 97 | 93 | 88 |
����40��ʱTiO2��xH2Oת������ߵ�ԭ��__________________��
��4��Li2Ti5O15��Ti�Ļ��ϼ�Ϊ+4�����й���������ĿΪ__________________��
��5��������Һ�ڡ���c(Mg2+)=0.02 mol/L������˫��ˮ�����ᣨ����Һ�������1������ʹFe3+ǡ�ó�����ȫ����Һ��c(Fe3+)=1��10-5 mol/L����ʱ�Ƿ���Mg3(PO4)2�������ɣ�___________����ʽ���㣩��
FePO4��Mg3(PO4)2��Ksp�ֱ�Ϊ1.3��10-22��1.0��10-24��
��6��д�����������բڡ�����FePO4�Ʊ�LiFePO4�Ļ�ѧ����ʽ______��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ð���٤�����ɼ������ۣ���Ҫ����գ�
(1)��״���£�5L CH4������5L NH3�����ԭ�Ӹ���֮��Ϊ______________��
(2)ͬ�¡�ͬѹ�£���ͬ�����N2��CO�����ܶ�֮��Ϊ______________��
(3)ͬ�¡�ͬѹ�£���������һ����̼�Ͷ�����̼�����֮��Ϊ______________��
(4)ͬ�¡�ͬѹ�£��������N2��O2��������Ϊ________________
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com