
【题目】23℃时,有体积相同的四种溶液:①pH=3的 CH3COOH溶液②pH=3的盐酸③pH=11的氨水④pH=11的NaOH溶液。下列说法不正确的是
A.用蒸馏水将①稀释则 ![]() 增大
增大
B.等体积②和③的溶液混合后,溶液呈酸性
C.将③逐渐滴入②中,水的电离程度先增大后减小
D.③和④分别用②中和,消耗②的体积:③>④
【答案】B
【解析】
醋酸和一水合氨都是弱电解质,溶液中存在电离平衡,氯化氢和氢氧化钠是强电解质,完全电离。
A、用蒸馏水将CH3COOH溶液稀释, c(CH3COO-)、c(CH3COOH) 均减小,但是醋酸的电离平衡向右移动,c(CH3COOH)减小的程度更大,故![]() 增大,故A正确;
增大,故A正确;
B、pH=11的氨水与pH=3的盐酸溶液等体积混合,氨水平衡状态下的氢氧根离子浓度和盐酸溶液中的氢离子浓度相同恰好反应,氨水又电离出铵根离子和氢氧根离子,所以氨水有剩余,所以溶液pH大于7,故B错误;
C、将氨水逐渐滴入盐酸中,先反应生成氯化铵,铵根水解促进水的电离,而到后面氨水过量,又会抑制水的电离,所以水的电离程度先增大后减小,故C正确。
D、pH相等的氨水和氢氧化钠,氨水浓度大于氢氧化钠,且二者都是一元碱,中和酸的能力与碱的物质的量成正比,等体积等pH的氨水和氢氧化钠,氨水的物质的量大于氢氧化钠,所以③和④分别用等浓度的盐酸溶液中和,消耗盐酸溶液的体积:③>④,故D正确。
答案选B。


科目:高中化学 来源: 题型:
【题目】实验室用乙醇制取乙烯,用电石(主要成分为CaC2,含少量CaS)制取乙炔。
(1)实验室制取乙烯的化学方程式为_____________________________,可用于制取乙烯的发生装置是_______。(选填编号)

a b c d
(2)制备乙烯气体时,常因温度过高而观察到溶液变黑,同时能闻到有刺激性气味的气体生成。在乙烯气体的制备过程中,浓硫酸没有体现的性质是________。
a 吸水性 b 脱水性 c 强氧化性 d 酸性
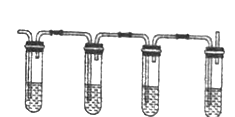
① ② ③ ④
有同学设计下列实验确认上述混合气体中有乙烯和二氧化硫。
上图中①、②、③、④装置盛放的试剂分别是(根据需要进行选择,填标号):
①_______________,②_______________,③_______________,④______________。
A 品红溶液 B NaOH溶液 C 浓硫酸 D 酸性高锰酸钾溶液
(3)实验室制备乙炔的化学反应方程式为_________________________________。实验室制乙炔时为避免电石和水反应过于激烈,除用分液漏斗控制滴速外,通常还可用_________代替水。为除去乙炔中混有的少量硫化氢杂质,可将气体通过___________(选填编号)。
a酸性KMnO4溶液 b CCl4 c NaOH溶液 d CuSO4溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了探究硫酸亚铁的分解产物,进行了如下图装置所示的实验,打开K1和K2,缓缓通入N2,一段时间后加热,实验后反应管中残留固体为红色粉末,BaCl2溶液中有白色沉淀产生,品红溶液中红色褪去,检查氢氧化钠溶液出口处无氧气产生。下列说法错误的是

A. 氢氧化钠溶液的作用是吸收多余的SO2气体
B. 反应管内产生的红色粉末可能是Fe2O3
C. BaCl2溶液的目的是检验SO3的存在,此处用Ba(NO3)2溶液也可以检验SO3
D. 反应管内得到的氧化产物和还原产物物质的量之比为1:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可逆反应L(s)+aG(g)=bR(g)达到平衡时温度和压强对该反应的影响如下图所示,x轴表示温度,y轴表示平衡混合气中G的体积分数,压强P1>P2,下列判断正确的是
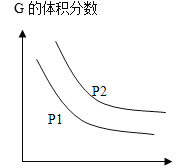
A.a>b
B.△H<0
C.当av正(G)=bv逆(R)可说明反应达到平衡状态
D.增加L的物质的量,可提高G的转化率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为探究Fe3+和Cu2+对H2O2分解反应的催化效果,某同学分别设计了图1、图2所示的实验

下列叙述中不正确的是
A.图1实验可通过观察产生气泡的快慢来比较反应速率的大小
B.若图1实验中反应速率为a>b,则一定可以说明Fe3+比Cu2+对H2O2分解催化效果好
C.图2实验可通过测定相同状况下产生的气体体积与反应时间来比较反应速率
D.图2中关闭A处活塞,将针筒活塞向外拉,松开后针筒活塞复原说明装置气密性好
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二甲醚是一种重要的清洁燃料,也可替代氟利昂作制冷剂等,对臭氧层无破坏作用。工业上可利用煤的气化产物(水煤气)合成二甲醚。请回答下列问题
(1)煤的气化的主要化学反应方程式为________________
(2)煤的气化过程中产生的有害气体H2S用Na2CO3溶液吸收,生成两种酸式盐,该反应的化学方程式为____________
(3)利用水煤气合成二甲醚的三步反应如下
①2H2(g)+CO(g)=CH3OH(g) △H=-90.8kJ.mo-1
②2CH3OH(g)= CH3OCH3(g)+ H2O(g) △H=-235kJ.mo-1
③CO(g)+H2O(g)=O2(g)+H2(g) △H=-413kJ.mo-1
总反应:3H2(g)+3CO(g)= CH3OCH3(g)+CO2(g)的△H=___________
一定条件下的密闭容器中,该总反应达到平衡,要提高CO的转化率,可以采取的措施是____(填字母代号)![]()
a. 高温高压 b.加入催化剂 c.减少CO2的浓度 d.增加Co的浓度 e.分离出二甲醚
(4)已知反应②2CH3OH(g)= CH3OCH3(g)+ H2O(g)某温度下的平衡常数为400.此温度下,在2L密闭容器中加入CH3OH,反应到某时刻测得各组分的浓度如下:
物质 | CH3OH | CH3OCH3 | H2O |
物质的量(mol) | 0.88 | 1.2 | 1.2 |
①加入的CH3OH的起始浓度为_________
②比较此时正、逆反应速率的大小:v正________v逆(填少”、“<”或“=”)
③若加入CH3OH后,经10min反应达到平衡,此时CH3OH的转化率a(CH3OH)=_________c(CH3OCH3)=____________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关从海带中提取碘的实验原理和装置能达到实验目的的是

A. 用装置甲灼烧碎海带
B. 用装置乙过滤海带灰的浸泡液
C. 用装置丙制备用于氧化浸泡液中I的Cl2
D. 用装置丁吸收氧化浸泡液中I后的Cl2尾气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】120℃时,1molCO2和3molH2通入1L的密闭容器中反应生成CH3OH和水。测得CO2和CH3OH的浓度随时间的变化如图所示。下列有关说法中不正确的是

A.0~3min内,H2的平均反应速率为0.5mol·L-1·min-1
B.该反应的化学方程式:CO2(g)+3H2(g)=CH3OH(g)+H2O(g)
C.容器内气体的压强不再变化时,反应到达平衡
D.10min后,反应体系达到平衡
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铜是重要的金属材料。
(1)工业上可用Cu2S和O2反应制取粗铜,该反应中氧化剂为________。电解粗铜制取精铜,电解时,阳极材料是________,电解液中必须含有的阳离子是________。
(2)在100 mL 18 mol·L-1浓硫酸中加入过量的铜片,加热使之充分反应,反应中被还原的H2SO4为________mol。
(3)电子工业曾用质量分数为30%的FeCl3溶液腐蚀敷有铜箔的绝缘板制印刷电路板,为了从使用过的废腐蚀液中回收铜,并重新得到FeCl3溶液,设计如下实验流程。
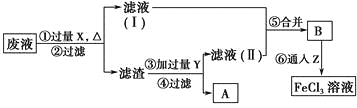
上述流程中,所加试剂的化学式为:X________,Y________,Z________;第⑥步反应的离子方程式为___________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com