
����Ŀ����֪2A(g)��B(g)![]() 2C(g)����H����a kJ��mol��1(a>0)����һ���д����Ĺ̶��ݻ��������м���2 mol A��1 mol B����500 ��ʱ��ַ�Ӧ��ƽ���C��Ũ��Ϊ�� mol��L��1���ų�������Ϊb kJ��
2C(g)����H����a kJ��mol��1(a>0)����һ���д����Ĺ̶��ݻ��������м���2 mol A��1 mol B����500 ��ʱ��ַ�Ӧ��ƽ���C��Ũ��Ϊ�� mol��L��1���ų�������Ϊb kJ��
(1)��֪��A(g)��X(g)![]() 2B(g)����H����133.2 kJ��mol��1��
2B(g)����H����133.2 kJ��mol��1��
5A(g)��X(g)![]() 4C(g)����H����650.4 kJ��mol��1����a��________��
4C(g)����H����650.4 kJ��mol��1����a��________��
(2)��ͬ�¶��¸÷�Ӧ��ƽ�ⳣ�������ʾ���ɴ˿���֪������T1________T2(�>����������<��)��
T/K | T1 | T2 | T3 |
K | 1.00��107 | 2.45��105 | 1.88��103 |
����ԭ���������У�ֻ����2 mol C��500 ��ʱ��ַ�Ӧ��ƽ�����������Ϊc kJ��C��Ũ��________________�� mol��L��1(�>����������<��)��a��b��c֮��Ĺ�ϵΪ________________��
(3)����ͬ������Ҫ��õ�2a kJ��������������ʵ����ʵ���������________(�����)��
A��4 mol A��2 mol B
B��4 mol A��2 mol B��2 mol C
C��4 mol A��4 mol B
D��6 mol A��4 mol B
(4)��������������Ϊ��ѹ����(��Ӧǰ�����ͬ)����ʼʱ����2 mol A��1 mol B��500 ��ʱ��ַ�Ӧ��ƽ��ų�������Ϊd kJ����d________b(�>����������<��)��������____________________________________��
(5)��һ���¶��£���һ���ݻ��ɱ�������У�ͨ��3 mol A��2 mol B�������������ַ�Ӧ��ƽ��ʱ�������������ʵ���Ϊ��ʼʱ��90%������ͬһ��Ӧ�¶ȣ�����ͬ�����У�����ʼ���ʵ�����Ϊ4 mol A��3 mol B��2 mol C����ƽ��ʱA�İٷֺ���________(����䡱�������С������ȷ����)��
���𰸡�258.6<��a��b��cD>���ڷ�Ӧ������ѹǿ��ѹ�������ں�������������ת���ʸ����ȸ����
��������
(1)���ݸ�˹���ɿ�֪-a=��-650.4����2-��-133.2����2=-258.6����a=258.6��(2)���ݸ÷�ӦΪ���ȷ�Ӧ���¶����ߣ�ƽ�������ƶ���ƽ�ⳣ��K��С����ϱ������ݵó�T1<T2������ƽ��״̬��ת�������أ�����2 mol A��1 mol B�����2 mol C��ƽ��״̬��ͬ������ƽ��ʱC��Ũ����ͬ����������غ㶨�ɣ�ǰ�߷ų��������ͺ������յ�����֮�͵���a���ʴ�Ϊ��<������a��b��c ��(3)��Ϊ���淴Ӧת����һ���ﲻ��100%��A��B��C����ѡ����Ҫ�õ�2a kJ��������ת������ﵽ100%�������ܣ��ʴ�Ϊ��D ��(4)��Ϊ����Ӧ�ᵼ���������ʵ������٣����Ժ�ѹ���������С������ں���ѹǿ��������ת���ʸ����ȸ���ʴ�Ϊ��>�����ڷ�Ӧ������ѹǿ��ѹ�������ں�������������ת���ʸ����ȸ��ࣻ(5)��Ϊ�Ǻ�ѹ����������������½�����ƽ��״̬���ڵ�Чƽ�⣬����A�ĺ�����ͬ���ʴ�Ϊ�����䡣



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ͼ���Т٢ڢܱۢ�ʾ��ͬ��ѧԪ������ɵĻ�����,ͼ�ұ�ʾ���ĸ����幹�ɵĻ��������˵������ȷ����(����)
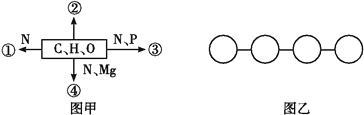
A. ��ͼ���еĢڴ���������Ƥ�º�����������Χ�Ȳ�λ,�����֬��
B. ��ͼ���Т������ա����ݺ�ת������,��ܿ�����ˮ�Ҵ���ȡ
C. ͼ�����������ǰ�����,��û����ﳹ��ˮ���IJ�������ԭ��������3��
D. ͼ��������������������������,��û����ﳹ��ˮ���IJ�����5��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ݱ�����ijЩ�������ϻ����������ͬλ���22286Rn���Ӷ����������Σ������ͬλ��ԭ�ӵ��������ͺ��������֮��Ϊ
A. 136 B. 50 C. 86 D. 222
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ɷ��Ǹ��л�ѧѧϰ���õķ���֮һ��ij��ѧ�о���ѧϰС����ѧϰ�ˡ���ѧ��Ӧԭ���������������µĹ����ܽᣬ������ȷ����
�������£�pH��3�Ĵ�����Һ��pH��11��NaOH��Һ�������ϣ�����c (Na+) + c(H+)��c(OH��) + c(CH3COO��)
�����ѽ�����ѧƽ���ij���淴Ӧ�����ı�����ʹ��ѧƽ��������Ӧ�����ƶ�ʱ��������İٷֺ���һ�����ӡ�
�������£�AgCl��ͬ���ʵ���Ũ�ȵ�CaCl2��NaCl��Һ�е��ܽ����ͬ
�������£���֪�������ƽ�ⳣ��ΪKa�������ˮ��ƽ�ⳣ��ΪKh��ˮ�����ӻ�ΪKw�����У�Ka��Kh��Kw
����⾫��ͭʱ���������Һ��ͭ����Ũ�Ȳ��� ��
A���٢� B���٢ڢ� C���٢ڢܢ� D���٢ڢۢ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��A��һ�ֳ����ĵ��ʣ�B��CΪ�����Ļ����A��B��C������Ԫ��x����������ͼ��ʾ��ת����ϵ(���ֲ��P��Ӧ��������ȥ)������˵������ȷ���ǣ� ��
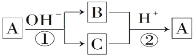
A. ��Ӧ�ٺ͢�һ��Ϊ������ԭ��Ӧ
B. ��Ӧ�ٺ͢ڻ�Ϊ���淴Ӧ
C. XԪ�ؿ����ǽ�����Ҳ�����Ƿǽ���
D. XԪ�ؿ���Ϊ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������������������Ħ���棬���ӽṹ��ͼ��ʾ�������й���������˵������ȷ���ǣ� ��
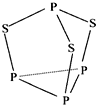
A. ����������Ԫ�صĻ��ϼ�Ϊ+3
B. ������22 g����ԭ�ӵ���ĿԼΪ1.806��1023
C. �����ʷ��ӽṹ��S��P��������������Ϊ8
D. �����ʷ����в����Ǽ��Թ��ۼ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ʯȼ��ȼ��ʱ����� SO2����������ж��ַ��������� SO2���ѳ���
��1��NaClO ������Һ���շ�����ҵ�Ͽ��� NaClO ������Һ����SO2��
�ٷ�Ӧ���ӷ���ʽ��__________________________________________��
��Ϊ���������Ч�ʣ����� Ni2O3��Ϊ�������ڷ�Ӧ�����в������ļ�������ԭ�Ӿ��м�ǿ�������������ɼӿ��SO2�����ա��ô����̵�ʾ��ͼ��ͼ��ʾ��
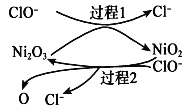
a.����1�����ӷ���ʽ��Ni2O3+ClO�� =2NiO2 +Cl���������2�����ӷ���ʽ____________��
b��Ca(ClO)2Ҳ����������������Ч����NaClO���ã�ԭ����________________��
��2����ѭ������Ҳ������SO2���ͻ�����Ⱦ��ͬʱ�����Ƶ������������������£�
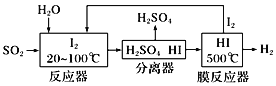
���ѭ�����յ��ܷ�ӦΪ��___________________________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����A��B��C��D��E���ֶ�����Ԫ�أ���֪���ڵ�A��B��C��D����Ԫ��ԭ�Ӻ�������㹲��24�����ӣ������ڱ��е�λ����ͼ��ʾ��E�ĵ��ʿ����ᷴӦ��1molE���������������ã��ڱ�״�����ܲ���33.6LH2��E����������A�������Ӻ�����Ӳ�ṹ��ȫ��ͬ
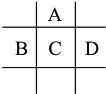
�ش��������⣺
(1) A��E�γɵĻ�����Ļ�ѧʽ��__________��B����������ﻯѧʽΪ_____________��
(2)D�ĵ�����ˮ��Ӧ�ķ���ʽΪ__________________________________________________��
(3) ��D��E�γɵĻ������ˮ��Һ�е����ռ���Һֱ���������۲쵽��������___________________���йط�Ӧ�����ӷ���ʽΪ��_____________________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������������ʣ�
��ϡ���� ��С�մ� �۰�ˮ �ܶ�����̼ ��FeCl3���� ��ϡNaOH��Һ ������������Һ
��1���������������ڵ���ʵ��������Ϊ______ ��
��2���������ᡢNaOH��Һ���ܷ�����ѧ��Ӧ���������Ϊ______��
��3��д��С�մ���θ�ᣨ��Ҫ�ɷ�Ϊϡ���ᣩ���õ����ӷ���ʽ��___________
��4��ʵ�����â��Ʊ�����Ļ�ѧ����ʽΪ_____________________________�������1molFeCl3ȫ���Ƴɽ��壬�ƵõĽ���________(ѡ������硱�������ԡ��������硱)��������Ŀ________NA(ѡ����ڡ������ڡ���С�ڡ�)
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com