
【题目】A是一种常见的单质,B、C为常见的化合物,A、B、C均含有元素x,它们有如图所示的转化关系(部分产物及反应条件已略去)。下列说法中正确的是( )
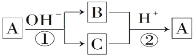
A. 反应①和②一定为氧化还原反应
B. 反应①和②互为可逆反应
C. X元素可能是金属,也可能是非金属
D. X元素可能为铝
【答案】A
【解析】
单质与强碱发生反应,生成了两种产物B和C,而且B和C均含有同一种元素,且B和C又可以在强酸的作用下发生反应,生成单质A,可以看出反应①是A物质的歧化反应,反应②应该是这种元素的归中反应,所以B和C中应该分别含有A的负价态物质以及正价态物质,故判断A一定是非金属元素。
A、①应该是A物质的歧化反应,反应②应该是一种元素的归中反应,则可以知道B和C中应该分别含有A的负价态物质以及正价态物质,所以反应①和②一定为氧化还原反应,故A正确;
B、可逆反应的定义是指在同一条件下,既能向正反应方向进行,同时又能向逆反应方向进行的反应,上述①和②两个反应的反应条件不相同,不是可逆反应,故B错误;
C、A、B和C中都含有X元素,反应①是A物质的歧化反应,反应②应该是这种元素的归中反应,所以B和C中应该分别含有A的负价态物质以及正价态物质,判断A一定是非金属元素,因为金属元素无负价,说明X元素是非金属元素,故C错误;
D、A、B和C都含有X元素,反应①是A物质的歧化反应,反应②应该是这种元素的归中反应,所以B和C中应该分别含有A的负价态物质以及正价态物质,判断A一定是非金属元素,因为金属元素无负价,说明X元素是非金属元素,X元素肯定不能为铝,故D错误;
综上所述,本题应选A.


 捷径训练检测卷系列答案
捷径训练检测卷系列答案 小夫子全能检测系列答案
小夫子全能检测系列答案科目:高中化学 来源: 题型:
【题目】如图是部分短周期元素化合价与原子序数的关系图,下列说法正确的是:( )
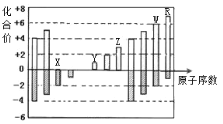
A. 原子半径:Z>Y>X
B. 气态氢化物的稳定性:R>W
C. WX3和水反应形成的化合物是离子化合物
D. Y和Z两者最高价氧化物对应的水化物的碱性:Z>Y
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫代硫酸钠(Na2S2O3),又名大苏打、海波,主要用于照相业作定影剂、作鞣革时重铬酸盐的还原剂,易溶于水,遇酸易分解。其工艺制备流程如下:

某化学兴趣小组同学模拟该流程设计了如下实验装置:

回答下列问题:
(1)a处可用来检验I中的反应是否发生,选用的试剂是______________,若要停止I中的化学反应,除停止加热外,还要采取的操作是________________________。
(2)加热I,使反应完全,发现浸入液面下的铜丝变黑,甲同学对黑色生成物提出如下假设:①可能是Cu2O ②可能是CuO;③可能是CuS;④_______。乙同学提出假设①一定不成立,该同学的依据是______;丙同学做了如下实验来验证黑色物质的组成:

基于上述假设分析,黑色物质的组成为__________________________(填化学式)。
(3)II中发生反应的化学方程式为_____________________,实验中通入的SO2不能过量,可能的原因是______________________。
(4)为检验制得的硫代硫酸钠产品的纯度,该小组称取5.0g产品配成250mL硫代硫酸钠溶液,并用间接碘量法标定该溶液的浓度:向锥形瓶中加入25.00mL 0.01mol·L-1的KIO3溶液,再加入过量的KI溶液并酸化,发生反应的离子方程式为___________,再加入几滴淀粉溶液,立即用所配的Na2S2O3溶液滴定,发生反应I2 + 2S2O32- == 2I- + S4O62-,当达到滴定终点时,消耗Na2S2O3溶液20.00mL,则该产品的纯度是____________(保留3个有效数字)。
(5)丁同学提出上述实验装置的设计存在不足,建议在I上__________;在I、II之间增加_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关说法正确的是( )
A. 0.1 mol·L-1 NH4C1溶液加蒸馏水稀释,溶液的pH不断减小
B. 常温下,pH=2的醋酸溶液与pH=12的NaOH溶液等体积混合后,溶液的pH<7
C. NH4HSO4溶液中滴加NaOH溶液至溶液pH=7,则[Na+]= 2[![]() ]
]
D. 0.1 mol·L-1的NaHA溶液,其pH=4时:[HA-]>[H+]>[H2A]>[A2-]
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定条件下,Na2S溶液中存在水解平衡:S2-+H2O![]() HS-+OH,在溶液中加入少量CuSO4固体,HS-浓度减小。下列说法正确的是
HS-+OH,在溶液中加入少量CuSO4固体,HS-浓度减小。下列说法正确的是
A. 稀释溶液,水解平衡常数增大
B. Ksp(CuS)<Ksp[Cu(OH)2]
C. 升高温度![]() 增大
增大
D. 加入MgCl2固体,HS-浓度减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知2A(g)+B(g)![]() 2C(g) ΔH=-a kJ·mol-1(a>0),在一个有催化剂的固定容积的容器中加入2 mol A和1 mol B,在500 ℃时充分反应达平衡后,C的浓度为ω mol·L-1,放出的热量为b kJ。
2C(g) ΔH=-a kJ·mol-1(a>0),在一个有催化剂的固定容积的容器中加入2 mol A和1 mol B,在500 ℃时充分反应达平衡后,C的浓度为ω mol·L-1,放出的热量为b kJ。
(1)已知:A(g)+X(g)![]() 2B(g) ΔH=-133.2 kJ·mol-1;
2B(g) ΔH=-133.2 kJ·mol-1;
5A(g)+X(g)![]() 4C(g) ΔH=-650.4 kJ·mol-1。则a=________。
4C(g) ΔH=-650.4 kJ·mol-1。则a=________。
(2)不同温度下该反应的平衡常数如表所示。由此可推知,表中T1________T2(填“>”“=”或“<”)。
T/K | T1 | T2 | T3 |
K | 1.00×107 | 2.45×105 | 1.88×103 |
若在原来的容器中,只加入2 mol C,500 ℃时充分反应达平衡后,吸收热量为c kJ,C的浓度________________ω mol·L-1(填“>”“=”或“<”),a、b、c之间的关系为________________。
(3)在相同条件下要想得到2a kJ热量,加入各物质的物质的量可能是________(填序号)。
A.4 mol A和2 mol B
B.4 mol A、2 mol B和2 mol C
C.4 mol A和4 mol B
D.6 mol A和4 mol B
(4)若将上述容器改为恒压容器(反应前体积相同),起始时加入2 mol A和1 mol B,500 ℃时充分反应达平衡后,放出的热量为d kJ,则d________b(填“>”“=”或“<”),理由是____________________________________。
(5)在一定温度下,向一个容积可变的容器中,通入3 mol A和2 mol B及固体催化剂,充分反应,平衡时容器内气体物质的量为起始时的90%。保持同一反应温度,在相同容器中,将起始物质的量改为4 mol A、3 mol B和2 mol C,则平衡时A的百分含量________(填“不变”“变大”“变小”或“无法确定”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在紫外线的作用下,氧气可生成臭氧:3O2![]() 2O3,一定条件下该反应达到平衡状态的标志是( )
2O3,一定条件下该反应达到平衡状态的标志是( )
A. 单位时间内生成2 mol O3,同时消耗3 mol O2
B. O2的消耗速率0.3 mol·L-1·s-1,O3的消耗速率0.2 mol·L-1·s-1
C. 容器内,2种气体O3、O2浓度相等
D. 气体密度不再改变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】证明某溶液中不含Fe3+而可能含有Fe2+的实验操作如下:①加入足量新制氯水,②加入足量酸性高锰酸钾溶液,③加入少量硫氰化铵溶液,④加入氢氧化钠溶液。最佳的实验操作及顺序是( )
A.①③B.③②C.③①D.④①
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A是由导热材料制成的密闭容器,B是一耐化学腐蚀且易于传热的气球.关闭K2,将等量且少量的NO2通过K1、K3分别充入A、B中,反应起始时,A、B的体积相同.(已知:2NO2(g) ![]() N2O4(g) ΔH<0)
N2O4(g) ΔH<0)
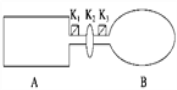
(1)一段时间后,反应达到平衡,此时A、B中生成N2O4的速率是vA______vB(填“>”、“<”或“=”);若打开活塞K2,气球B将______(填“变大”、“变小”或“不变”).
(2)关闭活塞K2,若在A、B中再充入与初始量相等的NO2,则达到平衡时,NO2的转化率αA将________(填“增大”、“减小”或“不变”);若分别通入等量的氖气,则达到平衡时,A中NO2的转化率将________,B中NO2的转化率将______(填“变大”、“变小”或“不变”).
(3)室温下,若A、B都保持体积不变,将A套上一个绝热层,B与外界可以进行热传递,则达到平衡时,______中的颜色较深.
(4)若在容器A中充入4.6 g的NO2,达到平衡后容器内混合气体的平均相对分子质量为57.5,则平衡时N2O4的物质的量为___________________.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com