
【题目】为提纯下列物质(括号内物质为杂质),所选用的除杂试剂和分离方法正确的是
被提纯的物质 | 除杂试剂 | 分离方法 | |
A | 乙酸乙酯(乙醇) | 乙酸 | 加热回流 |
B | 乙烷(乙烯) | 酸性KMnO4 | 洗气 |
C | 乙醇(乙酸) | 新制氧化钙 | 蒸馏 |
D | 苯(溴) | 碘化钾溶液 | 分液 |
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】近年来,科学家、合成了一系列具有独特化学性质的氢铝化合物(AlH3)n,常用作还原剂。已知,最简单的氢铝化合物的化学式为Al2H6,它的熔点为150℃且熔融状态不能导电,燃烧时放出大量的热量。Al2H6的球棍模型如下图所示。下列说法正确的是
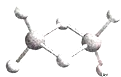
A.Al2H6中Al为-3价,H为+1价
B.Al2H6中含有离子键和极性共价键
C.Al2H6为离子化合物
D.Al2H6在空气中完全燃烧,产物为氧化铝和水
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】俄罗斯科学家在利用回旋加速器进行的实验中,用含20个质子的钙元素的同位素反复轰击含95个质子的镅元素,结果4次成功制成4个第115号元素的原子。这4个原子在生成数微秒后衰变成第113号元素。前者的一种核素为![]() X。下列有关叙述正确的是
X。下列有关叙述正确的是
A. X元素的核外电子数为288
B. 113号元素属于IIIB族
C. 镅元素属于过渡元素
D. 核素![]() X的质量数与中子数之差为173
X的质量数与中子数之差为173
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在“石蜡→液体石蜡→石蜡蒸气→裂化气”的变化过程中,被破坏的主要作用力依次是
A.范德华力、范德华力、氢键
B.范德华力、范德华力、共价键
C.共价键、共价键、共价键
D.范德华力、氢键、共价键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组为探究SO2的性质,按下图所示装置进行实验。

(1)装置A中盛放亚硫酸钠的仪器名称是________,其中发生反应的化学方程式为_____________
(2)实验过程中,装置B、C中发生的现象分别是_______________、______________,这些现象分别说明SO2具有的性质是______和 。装置B中发生反应的离子方程式为_________;
(3)装置D的目的是探究SO2与品红作用的可逆性,请写出实验操作及现象_________。
(4)尾气可采用________溶液吸收。
(5)碳单质和浓硫酸会在加热时发生反应,写出反应化学方程式
除去CO2中含有的少量SO2可选择通过 溶液 。
(6)描述实验室稀释浓硫酸的方法
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】决定物质性质的重要因素是物质结构。请回答下列问题。
(1)已知A和B为第三周期元素,其原子的第一至第四电离能如下表所示:
电离能/kJ·mol-1 | I1 | I2 | I3 | I4 |
A | 578 | 1817 | 2745 | 11578 |
B | 738 | 1451 | 7733 | 10540 |
A通常显 价,B元素的核外电子排布式为 。
(2)实验证明:KCl、MgO、CaO、TiN这4种晶体的结构与NaCl晶体结构相似(如下图所示),已知3种离子晶体的晶格能数据如下表:

离子晶体 | NaCl | KCl | CaO |
晶格能/kJ·mol-1 | 786 | 715 | 3401 |
则该4种离子晶体(不包括NaCl)熔点从高到低的顺序是 。其中MgO晶体中一个Mg2+周围和它最邻近且等距离的Mg2+有 个。
(3)金属阳离子含未成对电子越多,则磁性越大,磁记录性能越好。离子型氧化物V2O5和CrO2中,适合作录音带磁粉原料的是 。
(4)某配合物的分子结构如下图所示,其分子内不含有 (填序号)。

A.离子键
B.极性键
C.金属键
D.配位键
E.氢键
F.非极性键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海洋是一个巨大的资源宝库,海水中有大量可以利用的化学资源,例如氯化镁、氯化钠、溴化钠等。可用于制食盐、Mg、Br2、H2、Cl2、NaOH等化工原料。回答下列问题:
(1)Mg元素位于周期表第______周期_______族。
(2)写出NaOH的电子式_______________。
(3)写出电解饱和食盐水的离子方程式:____________。
(4)海水提溴要经过富集、氧化、提取的过程。其中氧化后生成的Br2可用Na2CO3溶液吸收,生成NaBr和NaBrO3及一种气体,写出该反应的化学方程式__________________。
(5)海水提取镁的过程中,得到MgCl2溶液后,先蒸发浓缩、冷却结晶、过滤制得MgCl2·6H2O,然后在HCl气流中加热得到MgCl2,而不是直接蒸发MgCl2溶液的原因是______________。
(6)海洋底部存在的可燃冰,是可开发的中药能源。常温常压下燃烧3.2g甲烷生成液态水,放出178kJ/mol的热量。写出甲烷燃烧的热化学方程式_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A是一种重要的化工原料,它的产量可以衡量一个国家石油化工水平的高低。A、B、C、D在一定条件下存在如下转化关系(部分反应条件、产物被省略)。

(1)请写出A的结构简式 ;
(2)写出反应B+C→D的化学方程式 ;
(3)使1molA与氯气发生完全加成反应,然后使该加成反应的产物与氯气在光照的条件下发生完全取代反应,则两个过程中消耗的氯气的总的物质的量是 mol;
(4)制备D的实验装置图如图所示:收集产物的试管中盛放的液体为 ;
装置中长颈漏斗除起冷凝作用外,另一重要作用是: 。

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com