
分析 (1)元素周期表中非金属性最强的元素是F,最外层7个电子,容易得到1个电子达到8个电子的稳定结构;
(2)同一周期,原子序数越大,半径越小;原子序数越大,元素的非金属性越强,其对应最高价氧化物的水合物的酸性越强(0族除外);
(3)同一主族,原子序数越小,半径越小,依据最低负价判断氢化物的化学式;
(4)在金属与非金属分界线附近的元素适合作半导体材料.
解答 解:(1)元素周期表中非金属性最强的元素是F,最外层7个电子,容易得到1个电子达到8个电子的稳定结构,故答案为:F;得;
(2)钠元素的原子序数最小,半径最大,Cl的原子序数最大,非金属性最强,其最高价氧化物的水合物为高氯酸,故答案为:Na;Cl;HClO4;
(3)VA族中的原子序数最小,故半径最小,由于N的最低负价我-3,故氢化物为NH3,故答案为:N;NH3;
(4)Si处于金属与非金属交界处,能作半导体材料,故答案为:Si.
点评 本题考查结构性质位置关系应用,推断元素是解题关键,涉及元素非金属性比较、氢化物化学式书写等,难度中等.


科目:高中化学 来源: 题型:选择题
| A. | X的化学式为Ag2S | B. | 银针验毒时,空气中氧气得到电子 | ||
| C. | 反应中Ag和H2S均是还原剂 | D. | 每生成1mo1X,反应转移2mo1 e- |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
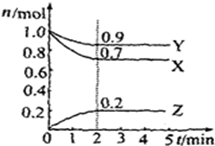 某温度时,在2L容器中X、Y、Z三种气体物质的物质的量(n)随着时间(t)变化的曲线如图所示.由图中数据分析:
某温度时,在2L容器中X、Y、Z三种气体物质的物质的量(n)随着时间(t)变化的曲线如图所示.由图中数据分析:查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 (写结构简式).
(写结构简式). 在一定条件下可水解为
在一定条件下可水解为 和R1-NH2,则F在强酸和长时间加热条件下发生水解反应的化学方程式是
和R1-NH2,则F在强酸和长时间加热条件下发生水解反应的化学方程式是 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 放热反应均是自发反应 | |
| B. | 物质的量增加的反应,△S为正值 | |
| C. | 如果△H和△S均为正值,当温度升高时,反应可能自发进行 | |
| D. | △S为正值的反应均是自发反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③⑤ | B. | ①②⑤ | C. | ②⑤⑥ | D. | ①④⑤⑥ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com