
【题目】常温下有A、B、C、D四种无色溶液,它们分别是CH3COONa溶液、NH4Cl溶液、盐酸和Na2SO4溶液中的一种。已知A、B溶液中水的电离程度相同,A、C溶液的pH相同。下列说法中不正确的是
A.D溶液的pH=7
B.四种溶液相比,C溶液中水的电离程度最小
C.A与C等体积混合后,溶液中有c(Cl)>c(H+)>c(NH4+)>c(OH)
D.B与D等体积混合后,溶液中有c(OH)=c(CH3COOH)+c(H+)
【答案】C
【解析】
CH3COONa、NH4Cl在溶液中都发生水解,从而促进水电离,盐酸直接电离出H+,抑制水电离,Na2SO4对水的电离不产生影响;NH4Cl溶液、盐酸都显酸性,CH3COONa溶液显碱性,Na2SO4溶液显中性。由“A、B溶液中水的电离程度相同,A、C溶液的pH相同”,可确定A为NH4Cl溶液,B为CH3COONa,C为盐酸,D为Na2SO4溶液。
A. 常温下,D溶液(Na2SO4溶液)中,Na2SO4对水的电离不产生影响,所以其pH=7,A正确;
B. CH3COONa、NH4Cl促进水电离,盐酸抑制水电离,Na2SO4对水的电离不产生影响,所以C溶液(盐酸)中水的电离程度最小,B正确;
C. 因为NH4Cl与HCl的pH相同,所以c(NH4Cl)>c(HCl),二者等体积混合后,虽然NH4+发生水解,但离子浓度减小很少,所以溶液中有c(Cl)>c(NH4+)>c(H+)>c(OH),C错误;
D. CH3COONa与Na2SO4等体积混合后,溶液中存在CH3COO-+H2O![]() CH3COOH
CH3COOH
+OH-、H2O![]() H++OH- ,所以c(OH)=c(CH3COOH)+c(H+),D正确。
H++OH- ,所以c(OH)=c(CH3COOH)+c(H+),D正确。
故选C。


 夺冠金卷全能练考系列答案
夺冠金卷全能练考系列答案科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A.25 ℃水的电离常数是1.0×10-12
B.中性溶液的c(H+)=![]()
C.纯水在100 ℃时,c(H+)>10-7 mol·L-1,所以此时纯水中c(H+)>c(OH-)
D.pH<7的溶液一定是酸溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用生物燃料电池原理研究室温下氨的合成,电池工作时MV2+/MV+在电极与酶之间传递电子,示意图如图所示。下列说法错误的是( )

A.相比现有工业合成氨,该方法条件温和,同时还可提供电能
B.阳极区,在氢化酶作用下发生反应H2+2MV2+=2H++2MV+
C.正极区,在固氮酶催化作用下发生反应N2+6MV++6H2O=2NH3+6MV2++6OH-
D.电池工作时质子通过交换膜由负极区向正极区移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚氯酸钠![]() 是一种高效的漂白剂和消毒剂,它在酸性条件下生成NaCl并放出
是一种高效的漂白剂和消毒剂,它在酸性条件下生成NaCl并放出![]() ,
,![]() 有类似
有类似![]() 的性质。某兴趣小组探究亚氯酸钠的制备与性质。
的性质。某兴趣小组探究亚氯酸钠的制备与性质。
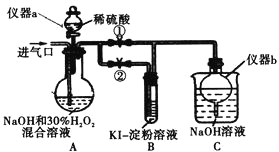
(I)制备亚氯酸钠
关闭止水夹![]() ,打开止水夹
,打开止水夹![]() ,从进气口通入足量
,从进气口通入足量![]() ,充分反应。
,充分反应。
(1)仪器a的名称为_________,仪器b的作用是_________。
(2)装置A中生成![]() 的化学方程式为_________。
的化学方程式为_________。
(3)若从装置A反应后的溶液中获得![]() 晶体,则主要操作有:减压蒸发浓缩、________、过滤、洗涤、干燥等。
晶体,则主要操作有:减压蒸发浓缩、________、过滤、洗涤、干燥等。
(II)探究亚氯酸钠的性质
停止通![]() 气体,再通入空气一段时间后,关闭止水夹
气体,再通入空气一段时间后,关闭止水夹![]() ,打开止水夹
,打开止水夹![]() ,向A中滴入稀硫酸。
,向A中滴入稀硫酸。
(4)请写出这时A中发生反应的离子方程式_________。
(5)开始时A中反应缓慢,稍后产生气体的速率急剧加快,请解释可能的原因_________。
(6)B中现象为_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列指定反应的离子方程式正确的是( )
A.醋酸与CaCO3反应:CaCO3+2H+=Ca2++CO2↑+H2O
B.向NaClO溶液中加入浓盐酸:ClO-+Cl-+2H+=Cl2↑+H2O
C.Cu与浓硝酸反应:3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O
D.向银氨溶液中加入CH3CHO溶液并水浴加热:CH3CHO+2Ag(NH3)2OH→CH3COO-+NH4++2Ag↓+3NH3+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】弱电解质的电离平衡、盐类的水解平衡和难溶物的溶解平衡均属于化学平衡。
(1)常温下,将0.1mol/L HCl溶液与0.1 mol/L MOH溶液等体积混合,测得混合后溶液的pH=5,则MOH在水中的电离方程式为__________。
(2)已知常温时CH3COOH![]() CH3COO – + H+,Ka=2×10–5,则反应CH3COO – + H2O
CH3COO – + H+,Ka=2×10–5,则反应CH3COO – + H2O![]() CH3COOH + OH–的平衡常数Kh=______。
CH3COOH + OH–的平衡常数Kh=______。
(3)已知H2A在水中发生电离:H2A=H++HA–,HA–![]() H++A2–。
H++A2–。
① 等物质的量浓度的两种溶液:NaHA溶液的pH_____(填“>”、“=”或“<”)Na2A溶液的pH。
② 已知0.1 mol·L-1 NaHA溶液的pH=2,该溶液中各种离子浓度由大到小的顺序是______。
③某温度下,若向0.1 mol·L–1的NaHA溶液中逐滴滴加0.1 mol·L–1 NaOH溶液至溶液呈中性。对该混合溶液,下列说法一定正确的是____(填序号)。
A.c(H+)·c(OH–)=1×10–14 B.c(Na+)=c(HA–)+2c(A2–)
C.溶液中水的电离程度逐渐减小 D.c(Na+)=c(HA–)+c(A2–)
(4)常温下,若在0.10 mol·L–1 CuSO4溶液中加入NaOH稀溶液充分搅拌,有浅蓝色氢氧化铜沉淀生成,当溶液的pH=8时,c(Cu2+)=________mol·L–1 {Ksp[Cu(OH)2]=2.2×10–20}。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中国女药学家屠呦呦因成功提取青蒿素而获得2015年诺贝尔医学奖,有关青蒿素的结构如图所示,下列关于靑蒿素的推断,不合理的是( )
A. 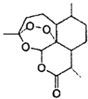 青蒿素的分子式是
青蒿素的分子式是![]()
B. 青蒿素所有碳原子均在同一平面上
C. 青蒿素在碱性条件下不能稳定存在
D. 青蒿素可以发生氧化反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铅蓄电池的电池反应为:![]()
![]()
![]()
![]() 下列说法正确的是
下列说法正确的是
A.放电时,正极的反应式是:![]()
B.放电时,电解质溶液中的H+向负极移动
C.充电时,阳极的电极反应为:![]()
D.充电时,当有20.7gPb生成时,转移的电子为0.1mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳酸二甲酯[(CH3O)2CO]是一种具有发展前景的“绿色”化工产品,电化学合成碳酸二甲酯的工作原理如图所示(加入两极的物质均是常温常压下的物质)。下列说法不正确的是( )
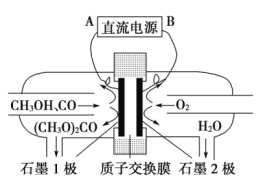
A.石墨2极与直流电源负极相连
B.石墨1极发生的电极反应为2CH3OH+CO-2e-=(CH3O)2CO+2H+
C.H+由石墨1极通过质子交换膜向石墨2极移动
D.电解一段时间后,阴极和阳极消耗的气体的物质的量之比为2:1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com