
【题目】弱电解质的电离平衡、盐类的水解平衡和难溶物的溶解平衡均属于化学平衡。
(1)常温下,将0.1mol/L HCl溶液与0.1 mol/L MOH溶液等体积混合,测得混合后溶液的pH=5,则MOH在水中的电离方程式为__________。
(2)已知常温时CH3COOH![]() CH3COO – + H+,Ka=2×10–5,则反应CH3COO – + H2O
CH3COO – + H+,Ka=2×10–5,则反应CH3COO – + H2O![]() CH3COOH + OH–的平衡常数Kh=______。
CH3COOH + OH–的平衡常数Kh=______。
(3)已知H2A在水中发生电离:H2A=H++HA–,HA–![]() H++A2–。
H++A2–。
① 等物质的量浓度的两种溶液:NaHA溶液的pH_____(填“>”、“=”或“<”)Na2A溶液的pH。
② 已知0.1 mol·L-1 NaHA溶液的pH=2,该溶液中各种离子浓度由大到小的顺序是______。
③某温度下,若向0.1 mol·L–1的NaHA溶液中逐滴滴加0.1 mol·L–1 NaOH溶液至溶液呈中性。对该混合溶液,下列说法一定正确的是____(填序号)。
A.c(H+)·c(OH–)=1×10–14 B.c(Na+)=c(HA–)+2c(A2–)
C.溶液中水的电离程度逐渐减小 D.c(Na+)=c(HA–)+c(A2–)
(4)常温下,若在0.10 mol·L–1 CuSO4溶液中加入NaOH稀溶液充分搅拌,有浅蓝色氢氧化铜沉淀生成,当溶液的pH=8时,c(Cu2+)=________mol·L–1 {Ksp[Cu(OH)2]=2.2×10–20}。
【答案】MOH![]() M+ + OH 5×10–10 < c(Na+)>c(HA)>c(H+)>c(A2)>c(OH) B 2.2×10–8
M+ + OH 5×10–10 < c(Na+)>c(HA)>c(H+)>c(A2)>c(OH) B 2.2×10–8
【解析】
(1)常温下,将0.1mol/L HCl溶液与0.1 mol/L MOH溶液等体积混合,所得物质为MCl,测得混合后MCl溶液的pH=5,由此可知该碱为弱碱;
(2)结合水的离子积常数和水解平衡常数求算公式计算;
(3)①由H2A=H++HA–,HA–![]() H++A2–可知NaHA该盐为强酸强碱盐,Na2A为强碱弱酸盐,可以利用盐类水解的规律求解;
H++A2–可知NaHA该盐为强酸强碱盐,Na2A为强碱弱酸盐,可以利用盐类水解的规律求解;
②由0.1 mol·L-1 NaHA溶液的pH=2可知,该溶液中主要存在HA–![]() H++A2–,可以据此回答;
H++A2–,可以据此回答;
③由溶液呈中性可知溶液中氢离子的浓度等于氢氧根的浓度;
(4)结合Ksp[Cu(OH)2]=2.2×10–20进行计算求解;
(1)常温下,将0.1mol/L HCl溶液与0.1 mol/L MOH溶液等体积混合,所得物质为MCl,测得混合后MCl溶液的pH=5,由此可知该碱为弱碱,故MOH在水中的电离方程式为MOH![]() M+ + OH;
M+ + OH;
(2)![]() =5×10–10
=5×10–10
(3)①由H2A=H++HA–可知NaHA该盐为强酸强碱盐,故该盐为中性盐溶液的PH=7,Na2A为强碱弱酸盐,故溶液呈碱性PH>7,故答案为“<”;
②由题中信息可知溶液中c(Na+)=0.1 mol·L-1>c(HA-),溶液中存在HA–![]() H++A2–,
H++A2–,![]() 可知:c(Na+)>c(HA)>c(H+)>c(A2)>c(OH);
可知:c(Na+)>c(HA)>c(H+)>c(A2)>c(OH);
③溶液呈中性可知![]() ,则可知:
,则可知:
A.c(H+)·c(OH–)=kw由于温度未知,故数值不能确定;
B.由电荷守恒可知c(Na+)+c(H+)=c(HA–)+2c(A2–)+c(OH-)又![]() ,故c(Na+)=c(HA–)+c(A2–);
,故c(Na+)=c(HA–)+c(A2–);
C.0.1 mol·L-1 NaHA溶液的pH=2,由此可知最初溶液呈现酸性是HA–![]() H++A2–,抑制水的电离,故随着加入碱发生中和反应,水的电离程度逐渐增大;
H++A2–,抑制水的电离,故随着加入碱发生中和反应,水的电离程度逐渐增大;
D.由B可知D选项错误;
(4)由Ksp[Cu(OH)2]=![]() =2.2×10–20可知c(Cu2+)=2.2×10–8
=2.2×10–20可知c(Cu2+)=2.2×10–8


科目:高中化学 来源: 题型:
【题目】用如图所示装置进行下列实验:将①中溶液滴入②中,预测的现象与实际相符的是
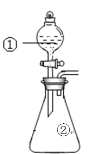
选项 | ①中物质 | ②中物质 | 预测②中的现象 |
A. | 稀盐酸 | 碳酸钠与氢氧化钠的混合溶液 | 立即产生气泡 |
B. | 浓硝酸 | 用砂纸打磨过的铁片 | 产生红棕色气体 |
C. | 氯化铵溶液 | 氢氧化镁沉淀 | 白色沉淀溶解 |
D. | 碳酸氢钠溶液 | 苯酚钠溶液 | 溶液变浑浊 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,体积相同、浓度均为1.0 mol·L–1的HX溶液、HY溶液,分别加水稀释,稀释后溶液的pH随稀释倍数的对数的变化如图所示,下列叙述正确的是( )
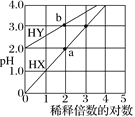
A.HX是强酸,溶液每稀释10倍,pH始终增大1
B.常温下HY的电离常数约为1.0×10–4
C.溶液中水的电离程度:a点大于b点
D.消耗同浓度的NaOH溶液体积:a点大于b点
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上用钛白渣[主要成分为FeSO4,还含有少量Fe2(SO4)3、MgSO4及TiOSO4]为主要原料生产氧化铁黄(FeOOH)的一种工艺流程如下:
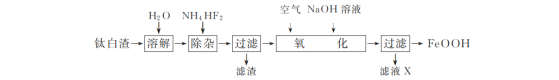
(1)“溶解”时,TiOSO4发生水解生成难溶于水的H2TiO3,反应的化学方程式为________。
(2)“除杂”时,加入NH4HF2固体的作用是________。
(3)“氧化”时,Fe2+生成FeOOH的离子方程式是________。
(4)滤液X中主要含有的阳离子是________(填化学式)。
(5)实验测得反应溶液的pH、温度对氧化铁黄产率的影响如图所示。
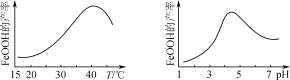
①反应温度宜选择________。
②氧化时应控制pH的合理范围是4.5左右,pH过小或过大均会导致氧化铁黄产率较低,其可能原因是__________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下有A、B、C、D四种无色溶液,它们分别是CH3COONa溶液、NH4Cl溶液、盐酸和Na2SO4溶液中的一种。已知A、B溶液中水的电离程度相同,A、C溶液的pH相同。下列说法中不正确的是
A.D溶液的pH=7
B.四种溶液相比,C溶液中水的电离程度最小
C.A与C等体积混合后,溶液中有c(Cl)>c(H+)>c(NH4+)>c(OH)
D.B与D等体积混合后,溶液中有c(OH)=c(CH3COOH)+c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了配制NH4+浓度与Cl-的浓度比为1:1的溶液,可在NH4Cl溶液中加入:①适量HCl②适量NaCl③适量的氨水④适量的NaOH,正确的是
A. ①② B. ④ C. ③④ D. ③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,有体积相同的四种溶液:①pH=3的CH3COOH溶液;②pH=3的盐酸;③pH=11的氨水;④pH=11的NaOH溶液。下列说法正确的是
A.①和②混合溶液中:c(H+)=3.0 mol·L-1
B.①和④混合溶液中:c(Na+)=c(CH3COO-)+c(CH3COOH)
C.②和③混合溶液中:c(Cl-)+c(H+)>c(NH4+)+c(OH-)
D.四种溶液稀释100倍,溶液的pH:③>④>②>①
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】β硝基苯乙烯是一种黄色针状晶体,熔点55~58 ℃,沸点250~260 ℃,不溶于水,易溶于乙酸、二氯甲烷等有机溶剂。制备原理如下:
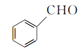 +CH3NO2
+CH3NO2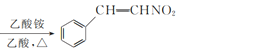
(1) 反应装置冷凝管中水应从________(填“a”或“b”)处通入。
(2)制备过程中,需在搅拌下滴加苯甲醛,控制滴加速率反应6 h,加热温度在110 ℃左右,那么采用的加热方法为________,如温度过高时,则可以采取________措施。
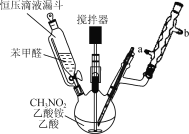
(3)反应混合液需加入一定量的水才析出黄色絮状物,加水的作用是________。
(4)过滤后用95%乙醇重结晶,再进行抽滤可获得黄色棱形晶体。抽滤装置所包含的仪器除减压系统外还有布氏漏斗和________(填仪器名称)。
(5)实验中使用恒压滴液漏斗的优点是________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Fe3O4中含有![]() 、
、![]() ,分别表示为Fe(Ⅱ)、Fe(Ⅲ),以Fe3O4/Pd为催化材料,可实现用H2消除酸性废水中的致癌物NO2-,其反应过程示意图如图所示,下列说法不正确的是
,分别表示为Fe(Ⅱ)、Fe(Ⅲ),以Fe3O4/Pd为催化材料,可实现用H2消除酸性废水中的致癌物NO2-,其反应过程示意图如图所示,下列说法不正确的是

A. Pd上发生的电极反应为:H2 - 2e- 2H+
B. Fe(Ⅱ)与Fe(Ⅲ)的相互转化起到了传递电子的作用
C. 反应过程中NO2-被Fe(Ⅱ)还原为N2
D. 用该法处理后水体的pH降低
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com