
����Ŀ������ǰ20��Ԫ���еIJ���Ԫ�ص�һЩ���ݣ�
A | B | C | D | E | F | G | H | I | J | |
ԭ�Ӱ뾶��10��10 m�� | 1.02 | 2.27 | 0.74 | 1.43 | 0.77 | 1.10 | 0.99 | 1.86 | 0.75 | 1.17 |
���̬ | +6 | +1 | �� | +3 | +4 | +5 | +7 | +1 | +5 | +4 |
��ͼ�̬ | ��2 | �� | ��2 | �� | ��4 | ��3 | ��1 | �� | ��3 | ��4 |
�Իش��������⣺
��1������10��Ԫ�ص縺��������_____����Ԫ�ط��ţ�����Ԫ��Bԭ��������7��Ԫ����Ԫ�����ڱ��е�λ�ã���____________�����̬ԭ�ӵĺ�������Ų�ʽ��___________��
��2��H��I��J����Ԫ�ض�Ӧ���ʵ��۵��������ߵ�˳���ǣ��õ��ʵľ��廯ѧʽ����______��
��3��Ԫ��E��C����Ԫ�ؿ��γ�һ����Է�������Ϊ60��һԪ������ӣ�������й��γɦҼ���м�֮��_________��I����Ԫ���γɵ�10���ӷ���X�Ŀռ乹��Ϊ_____��
��4��Ԫ�ؽ�Au���������ڱ��еĵ������ڣ���Cuͬ�壬һ��ͭ��Ͻ�������������ܶѻ��Ľṹ���ھ�����Cuԭ�Ӵ������ģ�Auԭ�Ӵ��ڶ���λ�ã���úϽ���Cuԭ����Auԭ������֮��Ϊ_______���þ����У�ԭ��֮�����������__________������������д���ܣ���ԭ�ӿɽ��뵽��Cuԭ����Auԭ�ӹ��ɵ��������϶�С�����Cuԭ����Auԭ�ӵ�ͬ�������þ��崢���ľ����ṹ��CaF2�ṹ���ƣ��þ��崢���Ļ�ѧʽӦΪ___________ ��
��5����ͼ��IԪ���γɵĺ�����Ľṹ�����Ҫ˵��������������ˮ��ԭ��_______________
��6����ͼ��J��E��ɵľ���ṹ����ÿ����J��Χ���Jԭ����ĿΪ___���������߳�Ϊa pm��������ܶ�Ϊ���ú�a��NA�Ĵ���ʽ��ʾ��________________��g/mL����
���𰸡� O ������ VIII�� 1s22s22p63s23p63d64s2����[Ar]3d64s2�� N2��Na��Si 7��1 ������ 3:1 ������ H8AuCu3 HNO3�Ǽ��Է��ӣ������ڼ��Ե�ˮ�У�HNO3�����еĩ�OH����ˮ����֮���γ���� 12 ![]() ��1030
��1030
��������������ǰ20��Ԫ���У�A��C������ͼ�-2������VIA�壬A��+6�ۣ�Cֻ��-2�ۣ���AΪS��CΪOԪ�أ�E��J����+4��-4�ۣ�����IVA�壬E��ԭ�Ӱ뾶��С����E��CԪ�ء�J��Si��F��I����+5��-3�ۣ�����VA�壬F��ԭ�Ӱ뾶����I����F��PԪ�ء�I��NԪ�أ�G��+7��-1�ۣ�Ϊ��A��Ԫ�أ�G��ClԪ�أ�Dֻ��+3�ۣ�Ϊ��A��Ԫ�أ�ԭ�Ӱ뾶����Siԭ�Ӱ뾶������D��AlԪ�أ�B��H�������Ϊ+1��û�и��ۣ�����IA�壬B��ԭ�Ӱ뾶��Alԭ�Ӱ뾶��ܶ࣬���ܴ���ͬ���ڣ���BΪK��B��Hԭ�Ӱ뾶����̫��Ӧ���ڣ���HΪNa���ݴ˷������
��⣺�������Ϸ�����֪A��B��C��D��E��F��G��H��I��J�ֱ���S��K��O��Al��C��P��Cl��Na��N��Si����
��1��ͬ����������ҵ縺�Գ��������ƣ�ͬ�������϶��µ縺�Լ�С��������Ԫ���е縺������Ԫ������Ԫ�أ���Ԫ��Bԭ��������7��Ԫ��ΪFe�����ڵ�������VIII�壻��̬ԭ�Ӻ�������Ų�Ϊ1s22s22p63s23p63d64s2����[Ar]3d64s2����
��2��HΪNa��I��N��J��Si���䵥���γɵľ������ͷֱ��ǽ������塢���Ӿ����ԭ�Ӿ��壬���Ե��ʵ��۵��������ߵ�ΪN2��Na��Si��
��3��̼Ԫ�ء���Ԫ�ؼ���Ԫ�ؿ��γ�һ����Է�������Ϊ60��һԪ������ӣ�������ΪCH3COOH��������й��γ�7��������1���������������й��γ�����������֮��Ϊ7��1��������Ԫ���γɵ�10���ӷ���X�ǰ�������ԭ�ӵļ۲���Ӷ���Ϊ4����һ�Թµ��Ӷԣ���ռ乹��Ϊ�����Σ�
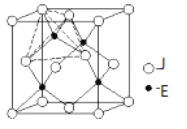
��4��Ԫ�ؽ�Au���������ڱ��еĵ������ڣ���Cuͬ�壬һ��ͭ��Ͻ�������������ܶѻ��Ľṹ���ھ�����Cuԭ�Ӵ������ģ�Auԭ�Ӵ��ڶ���λ�ã���úϽ���Cuԭ������6��1/2��3��Auԭ������8��1/8��1���������֮��Ϊ3:1���þ���Ϊ�������壬ԭ��֮����������ǽ�������CaF2�Ľṹ��ͼ ����ԭ�ӿɽ��뵽��Cuԭ����Auԭ�ӹ��ɵ��������϶�У���Hԭ��Ӧλ�ھ����ڲ�����Ӧ����8��H����þ��崢���Ļ�ѧʽӦΪH8AuCu3��
����ԭ�ӿɽ��뵽��Cuԭ����Auԭ�ӹ��ɵ��������϶�У���Hԭ��Ӧλ�ھ����ڲ�����Ӧ����8��H����þ��崢���Ļ�ѧʽӦΪH8AuCu3��
��5��ͼ�еĺ�����ΪHNO3��HNO3������ˮ��ԭ��a��HNO3�Ǽ��Է��ӣ������ڼ��Ե�ˮ�У�b��HNO3�����е�-OH����ˮ����֮���γ������
��6��J��Si��E��C���Ծ��������ϵ�SiΪ������֮���������SiΪ12��������Siԭ����ĿΪ8��1/8+6��1/2=4��������Cԭ����ĿΪ4�������߳�Ϊa pm���������Ϊa3��������ܶ�Ϊ![]() ��
��


 �����ҵ��ٿ���������������ϵ�д�
�����ҵ��ٿ���������������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����л�ѧʵ���Ӧ�������۶���ȷ�����߾��������ϵ����
ʵ�� | ���� | ���� | |
A | ��Ũ�Ⱦ�Ϊ0.1mol/L��NaHCO3��Һ��NaHSO3��Һ�еμӼ��η�̪�Լ� | ǰ����Һ��죬���߲���ɫ | NaHCO3ˮ�⣬��NaHSO3��ˮ�� |
B | ��NaAlO2��Һ��ͨ��NH3 | ��ɫ���� | Al(OH)3�����ܽ��������� |
C | �ýྻ��˿պȡ��Һ������ɫ��Ӧ | ����ʻ�ɫ | ԭ��Һ��һ����Na+����K+ |
D |
| �ձ��ڳ���ʯ��ˮ�ȱ���� | ̼�����Ʊ�̼�������ȸ��ֽ� |
A. A B. B C. C D. D
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ʳƷ��ҩƷ�İ�װ���г��ɷ���һЩ��װ����״�������ÿ������Ͽ��ܵ����Ƽ���������
A������̿�������� B��KMnO4��������
C���Ȼ��ơ������ D���轺�������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��A��B��C��D��E ���ֻ����������ij�ֳ���Ԫ�أ����ǵ�ת����ϵ��ͼ��ʾ������ A Ϊ������Һ��C Ϊ���ܵİ�ɫ���壬E ��������ˮ����ȡ A ��Һ���գ���ɫ��ӦΪ��ɫ(����ɫ�ܲ���)��

��ش��������⣺
(1)д����ѧʽ��A_____��B_____��C_____��D_____��E_____��
(2)д�����з�Ӧ�����ӷ���ʽ�� A��B��____ B��D��_____C��E��_____
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����з�Ӧ�����ӷ���ʽ�У���ȷ����(����)
A. ϡ�������ͭƬ�ϣ�Cu��2H��===Cu2����H2��
B. ϡ������Ba(OH)2��Һ��ϣ�SO![]() ��Ba2��===BaSO4��
��Ba2��===BaSO4��
C. ϡ������ڴ���ʯ�ϣ�CaCO3��2H��===Ca2����H2CO3
D. ��������ϡ�����ϣ�Fe2O3��6H��===2Fe3����3H2O
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������й�ʵ��˵������ȷ����
A. ����֧�Թ��зֱ��1 mL��ˮ�Ҵ���1.5 g���ӹ��壬�ټӵ�����������ƣ��Ƚ��Ҵ��������ǻ�����ԭ�ӵĻ�����
B. �������Ļ��ͷ����Һ�еμ�AgNO3��ϡHNO3��NaNO2��������ͷ�е���Ԫ��
C. ��2mL��ɫ��COCl2��Һ�м���Ũ���ᣬ��ʹ��Һ����ɫ
D. �Ʊ�Ħ����ʱ�������������������Ũ����Һ��������Һ�������־�ĤΪֹ�����ܽ���Һȫ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����з�Ӧ���ò���һ��������ͬ���칹�����
A. 2-��ϩ��HCl��Ӧ
B. 2-�ȶ���(![]() )��NaOH�Ҵ���Һ����
)��NaOH�Ҵ���Һ����
C. �ױ���Cl2��һ�������·���ȡ����Ӧ
D. �����ϩ(![]() )������ʵ�����Br2��Ӧ
)������ʵ�����Br2��Ӧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������(D)�������ϵ�ԭ�ϣ�������A�ϳɵõ���
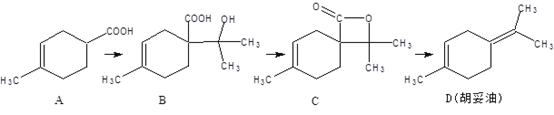
����˵����ȷ����
A. ���л���A���������ϩ���ͱ�ϩ����ȵõ��ģ���÷�Ӧ�ķ�Ӧ�������ڼӳɷ�Ӧ
B. �л���B������O2����������ȩ�����ܸ�NaHCO3��Һ��Ӧ�ų�CO2����
C. �л���C������ͬ���칹���в������з����廯�������
D. �л���D����������̼ԭ��һ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������л�����
��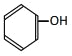 ��
�� 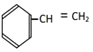 ��
��![]() ��
��![]() ��
�� 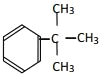 ��
��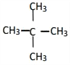
��1�����ڷ����廯�������______��
��2�����ڷ���������______��
��3�����ڱ���ͬϵ�����______��
��4������֬��������______��
��5�������������������______������ţ���
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com