
【题目】存放食品和药品的包装盒中常可发现一些袋装透明胶状颗粒,该颗粒材料可能的名称及其作用是
A.活性炭、吸附剂 B.KMnO4、氧化剂
C.氯化钠、干燥剂 D.硅胶、干燥剂
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】制取物质、探究物质的性质是学习化学必备的素养之一。
回答下列问题。
(1)实验室从含碘废液(除水外含CCl4、I2、I-等)中回收碘,其实验流程如下。

回答下列问题:
①物质X的名称为________;
②操作Ⅰ选用的装置为______(填标号);

③含碘废液中加入稍过量的Na2SO3溶液将I2还原为I-,反应的离子方程式为___。
④氧化剂Y可用Cl2,也可以用H2O2。将同物质的量的I-转化为I2,所需Cl2和H2O2的物质的量之比为________。
(2)某研究小组查阅资料知:氧化性的强弱顺序为:Cl2>IO3->I2。用如图装置对Cl2与KI溶液的反应进行探究,发现通入Cl2一段时间后,KI溶液变为黄色,继续通入Cl2,则溶液黄色变浅,最后变为无色。

①NaOH溶液的作用是______,反应的离子方程式为___________。
②溶液由黄色最后变为无色所发生反应的离子方程式为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某氯化钾样品中含有少量碳酸钾、硫酸钾和不溶于水的杂质。为了提纯氯化钾,先将样品溶于适量水中,充分搅拌后过滤,再将滤液按如图所示步骤进行操作。下列说法中正确的是
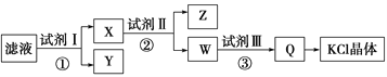
A. 起始滤液的pH=7
B. 试剂Ⅰ为Ba(NO3)2溶液
C. 步骤②中加入试剂Ⅱ的目的是除去Ba2+
D. 图示的步骤中必须要经过2次过滤操作
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某探究学习小组用如图所示装置进行SO2、Fe2+和Cl-还原性强弱比较实验,实验过程如下:

Ⅰ.先向B中的FeCl2溶液(约10mL)中通入Cl2,当B中溶液变黄时,停止通气。
Ⅱ.打开活塞b,使约2mL的溶液流入D试管中,检验取出溶液中的离子。
Ⅲ.接着再向B中通入一定量的SO2气体。
Ⅳ.更新试管D,重复过程Ⅱ,检验取出溶液中的离子。
(1)棉花中浸润的溶液为____________,目的是________________。
(2)实验室制备氯气的化学方程式为______________________。
(3)过程Ⅲ中一定发生反应的离子方程式为______________________,过程Ⅳ中检验取出溶液中是否含有硫酸根的操作是_____________________。
(4)该小组对SO2、Fe2+和Cl-还原性强弱比较期望达到的结论是_______________。
(5)甲、乙、丙三同学分别完成了上述实验,下表是他们的检测结果,他们的检测结果一定能够证明SO2、Fe2+和Cl-还原性强弱关系的是______________。
过程Ⅱ中检出离子 | 过程Ⅳ中检出离子 | |
甲 | 有Fe3+无Fe2+ | 有SO42- |
乙 | 既有Fe3+又有Fe2+ | 有SO42- |
丙 | 有Fe3+无Fe2+ | 有Fe2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知氨可以与灼热的氧化铜反应得到氮气和金属铜,用示意图中的装置可以实现该反应。

(1)A中装有Ca(OH)2和NH4Cl混合粉末,该反应的化学方程式是________________。
(2)B中加入的是碱石灰,其作用是_______________________________。
(3)实验时在C中观察到的现象是________________________________。发生反应的化学方程式是:______________________________。
(4)D中收集到的物质是____________,检验该物质的方法和现象是_______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】表是前20号元素中的部分元素的一些数据:
A | B | C | D | E | F | G | H | I | J | |
原子半径(10﹣10 m) | 1.02 | 2.27 | 0.74 | 1.43 | 0.77 | 1.10 | 0.99 | 1.86 | 0.75 | 1.17 |
最高价态 | +6 | +1 | ﹣ | +3 | +4 | +5 | +7 | +1 | +5 | +4 |
最低价态 | ﹣2 | ﹣ | ﹣2 | ﹣ | ﹣4 | ﹣3 | ﹣1 | ﹣ | ﹣3 | ﹣4 |
试回答下列问题:
(1)以上10种元素电负性最大的是_____(填元素符号).比元素B原子序数大7的元素在元素周期表中的位置:第____________,其基态原子的核外电子排布式是___________.
(2)H、I、J三种元素对应单质的熔点依次升高的顺序是(用单质的具体化学式排序)______.
(3)元素E与C及氢元素可形成一种相对分子质量为60的一元羧酸分子.其分子中共形成σ键与π键之比_________;I与氢元素形成的10电子分子X的空间构型为_____。
(4)元素金(Au)处于周期表中的第六周期,与Cu同族,一种铜金合金晶体具有立方最密堆积的结构,在晶胞中Cu原子处于面心,Au原子处于顶点位置,则该合金中Cu原子与Au原子数量之比为_______;该晶体中,原子之间的作用力是__________;上述晶体具有储氢功能,氢原子可进入到由Cu原子与Au原子构成的四面体空隙中。若将Cu原子与Au原子等同看待,该晶体储氢后的晶胞结构与CaF2结构相似,该晶体储氢后的化学式应为___________ 。
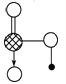
(5)如图是I元素形成的含氧酸的结构,请简要说明该物质易溶于水的原因:_______________
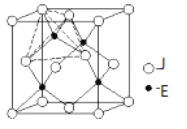
(6)如图是J和E组成的晶体结构,则每个与J周围最近J原子数目为___,若晶胞边长为a pm,则晶体的密度为(用含a、NA的代数式表示)________________(g/mL)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列事实或性质与胶体没有直接关系的是 ( )
A. 在冶金厂和水泥厂常用高压电除去大量的烟尘,以减少其对空气的污染
B. 将植物油倒入水中用力振荡形成油水混合物
C. 清晨,阳光穿过茂密的林木枝叶所产生的美丽的光柱
D. 在Fe(OH)3胶体中滴入稀硫酸,先看到红褐色沉淀生成而后沉淀溶解
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com